
【题目】教材插图是对教材内容高度概括的体现,也是为说明、理解、深化文字内容服务的。请回答下列问题:
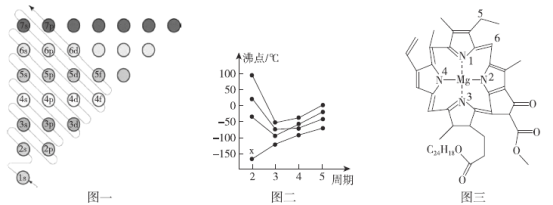
(1)图一为构造原理示意图,其含义是从H原子开始随着原子核电荷数递增,原子核每增加一个质子,核外便增加一个电子,电子大多按如图顺序填充。第四周期中,基态4s能级半充满的元素有___种,其中原子序数最大的基态原子的外围电子排布式为___。
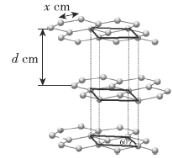
(2)图二中,每条折线代表周期表中IVA-VIIA某一族元素简单氢化物的沸点变化,其他三条折线与x所在折线变化趋势不完全相同的原因为___;与x点对应的简单氢化物互为等电子体的离子为___(写一种)。
(3)图三为卟啉配合物叶绿素的结构示意图,1号N原子和3号N原子与Mg2+形成的化学键类型为___;5号C原子和6号C原子的杂化方式分别为___、___;该分子中所含非金属元素的电负性由小到大的顺序为___。
(4)从石墨晶体结构示意图中截取石墨的晶胞如图所示,设阿伏加德罗常数为NA,已知sin60°=![]() ),石墨晶体的密度为___g·cm-3(列出计算式)。
),石墨晶体的密度为___g·cm-3(列出计算式)。
【答案】3 3d104s1 x点对应的氢化物为CH4,另外三条曲线中第二周期对应的气态氢化物分别为NH3、H2O、HF,其分子间存在氢键,导致沸点反常升高 NH4+ 配位键 sp3 sp2 H<C<N<O 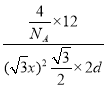
【解析】
(1)第四周期中,基态4s能级半充满的元素有K、Cr、Cu,共3种元素,其中原子序数最大为Cu,其基态原子的外围电子排布式为3d104s1;
故答案为:3;3d104s1;
(2)x点对应的氢化物为CH4,另外三条曲线中第二周期对应的气态氢化物分别为NH3、H2O、HF,其分子间存在氢键,导致沸点反常升高;与x点对应的简单氢化物互为等电子体的离子为NH4+;
故答案为:x点对应的氢化物为CH4,另外三条曲线中第二周期对应的气态氢化物分别为NH3、H2O、HF,其分子间存在氢键,导致沸点反常升高;NH4+;
(3)由卟啉配合物叶绿素的结构示意图,1号N原子和3号N原子提供孤电子对,Mg2+提供空轨道,形成的化学键类型为配位键;5号C原子形成4个σ键和6号C原子形成3个σ键,一个π键,杂化方式分别为sp3、sp2;同一周期从左到右电负性增大,该分子中所含非金属元素的电负性由小到大的顺序为H<C<N<O。
故答案为:配位键;sp3、sp2;H<C<N<O;
(4)从石墨晶体结构示意图中截取石墨的晶胞如图所示,设阿伏加德罗常数为NA,已知sin60°=![]() ),设晶胞的底边长为acm,高为hcm,由图知,晶胞中含4个C原子,石墨晶体的密度为ρ=
),设晶胞的底边长为acm,高为hcm,由图知,晶胞中含4个C原子,石墨晶体的密度为ρ=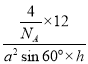 g·cm-3=
g·cm-3=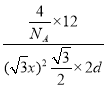 g·cm-3(列出计算式)。
g·cm-3(列出计算式)。
故答案为: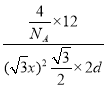 。
。


科目:高中化学 来源: 题型:
【题目】下列反应中,属于氧化反应的是( )
A.CH2=CH2+H2O![]() CH3CH2OH
CH3CH2OH
B.CH3Cl+Cl2![]() CH2Cl2+HCl
CH2Cl2+HCl
C.2CH3CHO+O2![]() 2CH3COOH
2CH3COOH
D.![]() +Br2
+Br2![]() +HBr
+HBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,3-二异丙烯基苯是工业上常用的交联剂,可用于制备高性能超分子聚合物,其结构如图所示。下列有关1,3-二异丙烯基苯的说法错误的是

A.能发生加聚反应
B.与液溴混合后加入铁粉可发生取代反应
C.分子中所有碳原子可能处于同一平面
D.其一氯代物有6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁被称为“第一金属”,铁及其化合物在生产、生活中有广泛用途。
(1)铁原子核外电子发生跃迁时会吸收或释放不同的光,可以用___________摄取铁元素的原子光谱。
(2)FeCl3的熔点为306℃,沸点为315℃。由此可知FeCl3属于______晶体。FeSO4常作净水剂和补铁剂,SO42-的立体构型是____________。
(3) 铁氰化钾K3[Fe(CN)6]是检验Fe2+的重要试剂。
①基态N原子的轨道表示式为___________。
②写出一种与铁氰化钾中配体互为等电子体的极性分子的化学式_______。
③铁氰化钾中,所涉及的元素的第一电离能由大到小的顺序为____________。
④铁氰化钾中,不存在___________(填字母标号)。
A.离子键 B. σ键 C. π键 D.氢键 E.金属键
(4)有机金属配位化合物二茂铁[(C5H5)2Fe]是汽油中的抗震剂。分子中的大 π键可用符号πmn表示,其中m代表参与形成大π键的原子数, n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π66),则![]() 中的大π键应表示为________,其中碳原子的杂化方式为________。
中的大π键应表示为________,其中碳原子的杂化方式为________。
(5)羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1mol [Fe(CO)5]分子中含_____molσ键。
(6)某种磁性氮化铁的结构如图所示,N随机排列在Fe构成的正四 面体空隙中。其中铁原子周围最近的铁原子个数为_____;六棱柱底边长为acm,高为c cm,阿伏加德罗常数的值为NA,则该磁性氮化铁的晶体密度为_________g/cm3(列出计算式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,wg某物质在足量氧气中充分燃烧,其燃烧产物立即与过量的Na2O2反应,固体质量增加wg。在①H2;②CO;③CO和H2的混合物 ④HCHO;⑤CH3COOH;⑥HO-CH2-CH2-OH中,符合题意的是
A. 均不符合 B. 只有①②③ C. 只有④⑤ D. 全部符合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上以菱铁矿(主要成分是FeCO3及少量SiO2)为原料制备高铁酸钠生产过程如下:
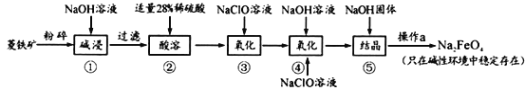
(1)Na2FeO4中铁元素的化合价为_____________,高铁酸钠用于杀菌消毒时的化学反应类型为_______________(填“氧化还原反应”、“复分解反应”或“化合反应”)。
(2)按照上述流程,步骤①中碱浸时能否用较便宜的Ca(OH)2替代NaOH___________ (填“能”或“不能”),理由是________________________。
(3)步骤③中检验Fe2+全部转化成Fe3+的方法是:___________________________。
(4)步骤④中除生成Na2FeO4外,还有NaCl生成,其离子方程式为_____________。己知步骤⑤是向Na2FeO4溶液中继续加入氢氧化钠固体得到悬浊液,则操作a的名称为_____。
(5)生产过程中,理论上每获得0.5mol的FeO42-消耗 NaClO的总质量为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵分解反应为NH2COONH4(s)![]() 2NH3(g)+CO2(g),在一体积恒定的容器里,发生上面的反应,可以判断该反应已经达到平衡的是
2NH3(g)+CO2(g),在一体积恒定的容器里,发生上面的反应,可以判断该反应已经达到平衡的是
A. 密闭容器中氨气的体积分数不变
B. 1 mol NH2COONH4分解同时有17g NH3消耗
C. 密闭容器中混合气体的密度不变
D. 混合气体的平均分子量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含苯酚的工业废水的处理流程如图所示。

(1)①流程图设备Ⅰ中进行的是操作________(填写操作名称)。实验室里这一步操作可以用_______(填仪器名称)进行。
②由设备Ⅱ进入设备Ⅲ的物质A是______________(填化学式,下同)。由设备Ⅲ进入设备Ⅳ的物质B是___________。
③在设备Ⅲ中发生反应的化学方程式为_____________________。
④在设备Ⅳ中,物质B的水溶液和CaO反应后,产物是NaOH、H2O和______。通过 _________________(填操作名称)操作,可以使产物相互分离。
⑤图中,能循环使用的物质是_______、_____________C6H6和CaO。
(2)为了防止水源污染,用简单而又现象明显的方法检验某工厂排放的污水中有无苯酚,此方法是____________。
从废水中回收苯酚的方法是①用有机溶剂萃取废液中的苯酚;②加入某种药品的水溶液使苯酚与有机溶剂脱离;③加入某物质又析出苯酚。试写出②、③两步的反应方程式:_________________________。
(3)为测定废水中苯酚的含量,取此废水100 mL,向其中加入浓溴水至不再产生沉淀为止,得到沉淀0.331 g,求此废水中苯酚的含量____________(mg·L-1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Al-Ag2O电池是水下大型机械常用电源,其工作原理如图所示。电池工作时,下列说法错误的是( )
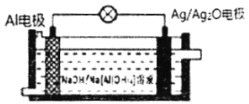
A.Al是电池的负极B.电池负极附近溶液pH升高
C.Al极反应式为: Al-3e- +4OH -==[AI(OH)4]-D.Ag/Ag2O 电极发生还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com