
【题目】已知:C(s)+CO2(g)![]() 2CO(g) △H>0。该反应达到平衡后,下列条件有利于反应向逆方向进行的是
2CO(g) △H>0。该反应达到平衡后,下列条件有利于反应向逆方向进行的是
A.升高温度和增大压强B.降低温度和减小压强
C.降低温度和增大压强D.升高温度和减小压强
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】I.2016年,我国研制的大型运输机运-20正式进入投产,标志着我国成为少数几个能生产大型军用运输机的国家之一。
(1)运-20的外壳大量使用了AM系列Mg-Al-Mn,铝的价电子排布图为_________________,第一电离能铝___________(填“大于”、“等于”或“小于”)镁
(2)为了减轻飞机的起飞重量并保持机身强度,运-20使用了大量的树脂材料,其中一种树脂材料的部分结构如图1所示,其中碳原子的杂化方式为___________,其个数比为___________


II.大型飞机的高推重比发动机被誉为航空工业皇冠上的“宝石”,采用大量的金属钨作为耐高温耐磨损材料
(3)钨元素位于第六周期第VIB族,价电子排布的能级与Cr相同,但排布方式与Cr有所不同,请写出钨原子的价层电子排布式___________
(4)图2为碳和钨形成的一种化合物的晶胞模型,碳原子和钨原子个数比为___________,其中一个钨原子周围距离最近且相等的碳原子有___________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醇酸树脂是一种成膜性好的树脂,如图是一种醇酸树脂的合成线路:

已知:![]()
![]()
![]() 反应①的化学方程式是______.
反应①的化学方程式是______.
![]() 写出B的结构简式是______.
写出B的结构简式是______.
![]() 反应①~③中属于取代反应的是______
反应①~③中属于取代反应的是______![]() 填序号
填序号![]() .
.
![]() 反应④的化学方程式为是______.
反应④的化学方程式为是______.
![]() 反应⑤的化学方程式是______.
反应⑤的化学方程式是______.
![]() 下列说法正确的是______
下列说法正确的是______![]() 填字母
填字母![]() .
.
a B存在顺反异构
b 1molE与足量的银氨溶液反应能生成2mol![]()
c F能与![]() 反应产生
反应产生![]()
d丁烷、![]() 丙醇和D中沸点最高的为丁烷
丙醇和D中沸点最高的为丁烷
![]() 写出符合下列条件的与
写出符合下列条件的与 互为同分异构体的结构简式______.
互为同分异构体的结构简式______.
![]() 能与浓溴水反应生成白色沉淀
能与浓溴水反应生成白色沉淀![]() 苯环上一氯代物有两种
苯环上一氯代物有两种![]() 能发生消去反应.
能发生消去反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,用浓度为0.1000 mol·L-1的NaOH溶液滴定20.00 mL浓度均为0.1000 mol·L-1的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法不正确的是( )

A.在相同温度下,同浓度的三种盐溶液的pH顺序:NaZ<NaY<NaX
B.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(Y-)>c(X-)>c(OH-)>c(H+)
C.根据滴定曲线,V(NaOH)=10 mL时,在HY溶液中水电离出的c(H+)=1.0×10-5 mol·L-1
D.HX与HY混合,达到平衡时:c(H+)=c(Y-)+c(X-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是 ( )
A.78g Na2O2溶于水后所得溶液中含有O22-数目为2NA
B.将2.24 LCl2(标况)通入到足量的NaOH溶液中,转移的电子数目为0.1NA
C.0.1 mol/LNH4Cl溶液中含有的NH4+数目小于0.1NA
D.用铅蓄电池电解氯化钠溶液,得到1 molH2时,理论上铅蓄电池中消耗氢离子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是
A.标准状况下,22.4L CCl4含有的分子数为NA
B.2.4gMg溶于足量稀盐酸,转移的的电子数为0.1NA
C.通常状况下,32gO2与32gO3所含的氧原子数均为2NA
D.物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-的数目为 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒液流电池是一种以钒为活性物质呈循环流动液态的氧化还原电池。钒电池电能以化学能的方式存储在不同价态钒离子的硫酸电解液中,通过外接泵把电解液压入电池堆体内,在机械动力作用下,使其在不同的储液罐和半电池的闭合回路中循环流动,采用质子交换膜作为电池组的隔膜,电解质溶液流过电极表面并发生电化学反应,进行充电和放电。下图为全钒液流电池放电示意图:

下列说法正确的是( )
A.放电时正极反应为:![]()
B.充电时阴极反应为:![]()
C.放电过程中电子由负极经外电路移向正极,再由正极经电解质溶液移向负极
D.该电池的储能容量,可以通过增大电解液存储罐的容积并增加电解液的体积来实现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】夏日的夜晚,常看到儿童手持荧光棒嬉戏,荧光棒发光原理是利用![]() 氧化草酸二酯(
氧化草酸二酯(![]() )产生能量,该能量被传递给荧光物质后发出荧光。草酸二酯的结构简式如图所示,下列有关草酸二酯的说法不正确的是( )
)产生能量,该能量被传递给荧光物质后发出荧光。草酸二酯的结构简式如图所示,下列有关草酸二酯的说法不正确的是( )
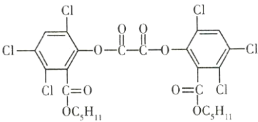
A.1mo草酸二酯与![]() 完全加成,需要消耗6mol
完全加成,需要消耗6mol![]()
B.草酸二酯的分子式为![]()
C.草酸二酯能发生取代反应
D.1mol草酸二酯最多可与4mol![]() 反应
反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴乙烷是一种重要的有机化工原料,其沸点为38.4℃。制备溴乙烷的一种方法是乙醇与氢溴酸反应。
(1)该反应的化学方程式是:___。
实际通常是用溴化钠与一定浓度的硫酸和乙醇反应.某课外小组欲在实验室制备溴乙烷的装置如图。
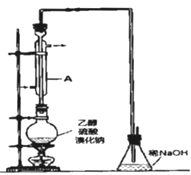
实验操作步骤如下:
①检查装置的气密性;
②在圆底烧瓶中加入95%乙醇、80%硫酸,然后加入研细的溴化钠粉末和几粒碎瓷片;
③小心加热,使其充分反应.
请问答下列问题:
(2)装置A的作用是__。
(3)反应时若温度过高,观察到还有一种红棕色气体(Br2)产生,反应结束后,得到的粗产品呈棕黄色。为了除去粗产品中的杂质,可选择下列试剂中的____(填写上正确选项的字母)。
a.稀氢氧化钠溶液 b.乙醇 c.四氯化碳 d.Na2SO3溶液
(4)要进一步制得纯净的溴乙烷,可继续用蒸馏水洗涤,分液后,再加入无水CaCl2,然后进行的实验操作是____(填写正确选项的字母)。
a.分液 b.蒸馏 c.萃取
(5)为了检验溴乙烷中含有溴元素,不能直接向溴乙烷中滴加硝酸银溶液来检验,通常采用的方法是取少量溴乙烷,然后___(按实验的操作顺序选填下列序号).
①加热 ②加入AgNO3溶液 ③加入稀HNO3酸化 ④加入NaOH溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com