
【题目】全钒液流电池是一种以钒为活性物质呈循环流动液态的氧化还原电池。钒电池电能以化学能的方式存储在不同价态钒离子的硫酸电解液中,通过外接泵把电解液压入电池堆体内,在机械动力作用下,使其在不同的储液罐和半电池的闭合回路中循环流动,采用质子交换膜作为电池组的隔膜,电解质溶液流过电极表面并发生电化学反应,进行充电和放电。下图为全钒液流电池放电示意图:

下列说法正确的是( )
A.放电时正极反应为:![]()
B.充电时阴极反应为:![]()
C.放电过程中电子由负极经外电路移向正极,再由正极经电解质溶液移向负极
D.该电池的储能容量,可以通过增大电解液存储罐的容积并增加电解液的体积来实现
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】聚酯纤维的结构为:![]() ,以下是聚酯纤维的合成流程图:
,以下是聚酯纤维的合成流程图:


(1)写出产物C的结构简式:______________________。
(2)写出①和②的反应条件及试剂:
____________________;____________________。
(3)反应类型为X的反应方程式______________________,反应类型Y是___________。
(4)写出D、E生成聚酯纤维的化学方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述不正确的是 ( )
A. 2.0 g D2O中含有的质子数、电子数均为NA
B. 室温下,7 g乙烯和丁烯的混合气体中所含的氢原子数目是NA
C. 室温下,2 L 0.05 mol·L-1 NH4NO3溶液中所含的氮原子数目是0.2NA
D. 256 g S8(分子结构如图 )含S—S键数目为7NA
)含S—S键数目为7NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:C(s)+CO2(g)![]() 2CO(g) △H>0。该反应达到平衡后,下列条件有利于反应向逆方向进行的是
2CO(g) △H>0。该反应达到平衡后,下列条件有利于反应向逆方向进行的是
A.升高温度和增大压强B.降低温度和减小压强
C.降低温度和增大压强D.升高温度和减小压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。回答下列问题:
(1)SiHCl3在常温常压下为易挥发的无色透明液体,遇水气时发烟生成(HSiO)2O等,写出该反应的化学方程式___。
(2)SiHCl3在催化剂作用下发生反应:
2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g) ΔH1=48kJ·mol-1
3SiH2Cl2(g)=SiH4(g)+2SiHCl3(g) ΔH2=-30kJ·mol-1
则反应4SiHCl3(g)=SiH4(g)+3SiCl4(g)的ΔH=___kJ·mol-1。
(3)对于反应2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。
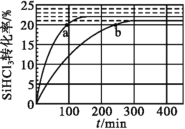
①343K时反应的平衡转化率α=___%。
②比较a、b处反应速率大小:va___vb(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件的密闭体系中,某反应c~t变化图如图。请完成填空:

(1)该反应的反应物是________。
(2)在2 min内a、b、c三者的反应速率分别是_______、_____、________。
(3)该反应的化学方程式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修3;物质结构与性质]
明朝《天工开物》中有世界上最早的关于炼锌技术的记载,锌也是人体必需的微量元素。回答下列问题:
(1)基态Zn原子核外的最高能层符号是________,基态Zn2+最外层电子排布式为________。
(2)硫酸锌溶于氨水形成[Zn(NH3)4]SO4溶液。
①组成[Zn(NH3)4]SO4的元素中,除Zn外其余元素的电负性由大到小排序为________。
②向[Zn(NH3)4]SO4溶液中逐滴滴加NaOH溶液,未出现浑浊,其原因是________。
③已知[Zn(NH3)4]2+的空间构型与![]() 相同,则在[Zn(NH3)4]2+中Zn2+的杂化类型为________,NH3易液化的原因是________________________________。
相同,则在[Zn(NH3)4]2+中Zn2+的杂化类型为________,NH3易液化的原因是________________________________。
④在[Zn(NH3)4]SO4晶体中存在的作用力有________。
A.离子键 B.极性共价键 C.氢键
D.配位键 E.范德华力 F.金属键
(3)ZnO与ZnS结构相似,ZnO的熔点为1975℃,ZnS的熔点约为1700℃。ZnO熔点比ZnS高的原因是________________________________。
(4)常温下金属锌晶体的晶胞为六方最密堆积(如图所示),若锌原子的半径为rnm,六棱柱的高为![]() ,则金属锌晶体的空间利用率是________(用含π的代数式表示)。
,则金属锌晶体的空间利用率是________(用含π的代数式表示)。
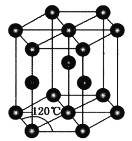
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二钴(Co2O3)常用于制滤光眼镜的添加剂、催化剂和强氧化剂。以含钴废料(主要成分CoO、Co2O3,含有少量MnO2、NiO、Fe3O4)为原料制备Co2O3的流程如下:

(1)研磨的目的是____________。滤渣1的主要成分为______________(填化学式)。
(2)酸浸时双氧水的作用有___________。不能用盐酸代替硫酸的原因是_________________。
(3)在实验室里,萃取操作要用到的玻璃仪器主要有___________。
(4)沉钴时发生反应的离子方程式为_______。煅烧时发生反应的化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应叙述相符合的是( )

A.图1表示在含等物质的量NaOH、![]() 的混合溶液中滴加
的混合溶液中滴加![]() 盐酸至过量时,产生气体的体积与消耗盐酸的关系
盐酸至过量时,产生气体的体积与消耗盐酸的关系
B.图2表示![]() 通入
通入![]() 溶液中pH的变化
溶液中pH的变化
C.图3表示![]() 酸性溶液与过量的
酸性溶液与过量的![]() 溶液混合时,
溶液混合时,![]() 随时间的变化
随时间的变化![]() 对该反应有催化作用
对该反应有催化作用![]()
D.图4表示已达平衡的某可逆反应,在![]() 时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂
时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com