
【题目】一定条件的密闭体系中,某反应c~t变化图如图。请完成填空:

(1)该反应的反应物是________。
(2)在2 min内a、b、c三者的反应速率分别是_______、_____、________。
(3)该反应的化学方程式是_______。
【答案】a 2 mol·L-1·min-1 3 mol·L-1·min-1 1 mol·L-1·min-1 2a![]() 3b+c
3b+c
【解析】
(1)在反应达到平衡前,反应物浓度会逐渐减小,生成物浓度会逐渐增大,据此判断;
(2)根据v=![]() 计算各种物质的反应速率;
计算各种物质的反应速率;
(3)利用不同物质表示的化学反应速率比等于化学方程式的相应物质的计量数的比书写反应方程式。
(1)根据图示可知a物质的浓度在达到平衡前逐渐减小,b、c浓度逐渐增大,因此a是反应物,b、c是生成物;
(2)在前2 min内a浓度减小了4 mol/L,所以用a表示的反应速率为v(a)=![]() =2 mol·L-1·min-1;
=2 mol·L-1·min-1;
在前2 min内b浓度增加了6 mol/L,所以用b表示的反应速率为v(b)=![]() =3 mol·L-1·min-1;
=3 mol·L-1·min-1;
在前2 min内c浓度增加了2 mol/L,所以用c表示的反应速率为v(c)=![]() =1 mol·L-1·min-1;
=1 mol·L-1·min-1;
(3)由于在同一反应中用不同物质表示的反应速率比等于化学方程式的计量数的比,v(a):v(b):v(c)=2:3:1,且a是反应物,b、c是生成物,2 min后各种物质的浓度不再发生变化,说明该反应为可逆反应,故该反应的化学方程式是2a![]() 3b+c。
3b+c。


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
【题目】关于化合物2苯基丙烯(![]() ),下列说法正确的是
),下列说法正确的是
A. 不能使稀高锰酸钾溶液褪色
B. 可以发生加成聚合反应
C. 分子中所有原子共平面
D. 易溶于水及甲苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,用浓度为0.1000 mol·L-1的NaOH溶液滴定20.00 mL浓度均为0.1000 mol·L-1的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法不正确的是( )

A.在相同温度下,同浓度的三种盐溶液的pH顺序:NaZ<NaY<NaX
B.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(Y-)>c(X-)>c(OH-)>c(H+)
C.根据滴定曲线,V(NaOH)=10 mL时,在HY溶液中水电离出的c(H+)=1.0×10-5 mol·L-1
D.HX与HY混合,达到平衡时:c(H+)=c(Y-)+c(X-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是
A.标准状况下,22.4L CCl4含有的分子数为NA
B.2.4gMg溶于足量稀盐酸,转移的的电子数为0.1NA
C.通常状况下,32gO2与32gO3所含的氧原子数均为2NA
D.物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-的数目为 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒液流电池是一种以钒为活性物质呈循环流动液态的氧化还原电池。钒电池电能以化学能的方式存储在不同价态钒离子的硫酸电解液中,通过外接泵把电解液压入电池堆体内,在机械动力作用下,使其在不同的储液罐和半电池的闭合回路中循环流动,采用质子交换膜作为电池组的隔膜,电解质溶液流过电极表面并发生电化学反应,进行充电和放电。下图为全钒液流电池放电示意图:

下列说法正确的是( )
A.放电时正极反应为:![]()
B.充电时阴极反应为:![]()
C.放电过程中电子由负极经外电路移向正极,再由正极经电解质溶液移向负极
D.该电池的储能容量,可以通过增大电解液存储罐的容积并增加电解液的体积来实现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A的结构如图所示,下面有关该物质的说法正确的是 ( )
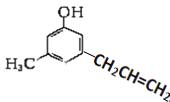
A.该物质的分子式是C10H10O
B.该物质可以发生消去反应
C.1mol该物质最多可以与2mol NaOH反应
D.1mol该物质可以与4mol浓溴水发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】夏日的夜晚,常看到儿童手持荧光棒嬉戏,荧光棒发光原理是利用![]() 氧化草酸二酯(
氧化草酸二酯(![]() )产生能量,该能量被传递给荧光物质后发出荧光。草酸二酯的结构简式如图所示,下列有关草酸二酯的说法不正确的是( )
)产生能量,该能量被传递给荧光物质后发出荧光。草酸二酯的结构简式如图所示,下列有关草酸二酯的说法不正确的是( )
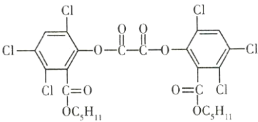
A.1mo草酸二酯与![]() 完全加成,需要消耗6mol
完全加成,需要消耗6mol![]()
B.草酸二酯的分子式为![]()
C.草酸二酯能发生取代反应
D.1mol草酸二酯最多可与4mol![]() 反应
反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,反应H2(g)+CO2(g)![]() H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=![]() 。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
起始浓度 | 甲 | 乙 | 丙 |
c(H2)/(mol·L-1) | 0.010 | 0.020 | 0.020 |
c(CO2)/(mol·L-1) | 0.010 | 0.010 | 0.020 |
下列判断不正确的是( )
A. 平衡时,乙中CO2的转化率大于60%
B. 平衡时,甲中和丙中H2的转化率均是60%
C. 平衡时,丙中c(CO2)是甲中的2倍,是0.008 mol·L-1
D. 反应开始时,乙中的反应速率最快,甲中的反应速率最慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是原子序数依次增大的四种短周期主族元素,X与Y位于同一主族,X与W能够形成多种化合物,其中一种为红棕色气体,Y与Z形成的一种化合物Y2Z2的分子结构模型为![]() 。下列叙述正确的是( )
。下列叙述正确的是( )
A.X与W、Y及Z均能组合成多种化合物B.简单离子半径:Y>Z>X>W
C.W的氧化物的水化物一定为强酸D.化合物Y2Z2中Y不满足8电子稳定结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com