
【题目】下列图示与对应叙述相符合的是( )

A.图1表示在含等物质的量NaOH、![]() 的混合溶液中滴加
的混合溶液中滴加![]() 盐酸至过量时,产生气体的体积与消耗盐酸的关系
盐酸至过量时,产生气体的体积与消耗盐酸的关系
B.图2表示![]() 通入
通入![]() 溶液中pH的变化
溶液中pH的变化
C.图3表示![]() 酸性溶液与过量的
酸性溶液与过量的![]() 溶液混合时,
溶液混合时,![]() 随时间的变化
随时间的变化![]() 对该反应有催化作用
对该反应有催化作用![]()
D.图4表示已达平衡的某可逆反应,在![]() 时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂
时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂
【答案】C
【解析】
![]() 先发生NaOH与HCl反应,再发生碳酸钠与盐酸反应生成碳酸氢钠,最后发生碳酸氢钠与盐酸的反应生成气体;
先发生NaOH与HCl反应,再发生碳酸钠与盐酸反应生成碳酸氢钠,最后发生碳酸氢钠与盐酸的反应生成气体;
B.![]() 通入
通入![]() 溶液中发生
溶液中发生![]() ↓,酸性增强,pH减小;
↓,酸性增强,pH减小;
C.发生氧化还原反应生成锰离子,![]() 对该反应有催化作用,反应加快;
对该反应有催化作用,反应加快;
D.![]() 时正逆反应速率同等程度的变大。
时正逆反应速率同等程度的变大。
![]() 先发生NaOH与HCl反应,再发生碳酸钠与盐酸反应生成碳酸氢钠,最后发生碳酸氢钠与盐酸的反应生成气体,且等物质的量NaOH、
先发生NaOH与HCl反应,再发生碳酸钠与盐酸反应生成碳酸氢钠,最后发生碳酸氢钠与盐酸的反应生成气体,且等物质的量NaOH、![]() ,不产生气体和产生气体消耗的酸应为2:1,与图象不符,故A错误;
,不产生气体和产生气体消耗的酸应为2:1,与图象不符,故A错误;
B.![]() 通入
通入![]() 溶液中发生
溶液中发生![]() ↓,酸性增强,pH减小,与图象不符,故B错误;
↓,酸性增强,pH减小,与图象不符,故B错误;
C.发生氧化还原反应生成锰离子,则![]() 随时间的变化而增大,且催化作用,一段时间内增加的更快,后来浓度变化成为影响速率的主要因素,反应物浓度减小,速率减慢,故C正确;
随时间的变化而增大,且催化作用,一段时间内增加的更快,后来浓度变化成为影响速率的主要因素,反应物浓度减小,速率减慢,故C正确;
D.![]() 时正逆反应速率同等程度的变大,可能为催化剂,若反应前后气体的物质的量不变,增大压强平衡不移动,速率增大,所以增大压强也可能符合,故D错误;
时正逆反应速率同等程度的变大,可能为催化剂,若反应前后气体的物质的量不变,增大压强平衡不移动,速率增大,所以增大压强也可能符合,故D错误;
故选:C。


科目:高中化学 来源: 题型:
【题目】全钒液流电池是一种以钒为活性物质呈循环流动液态的氧化还原电池。钒电池电能以化学能的方式存储在不同价态钒离子的硫酸电解液中,通过外接泵把电解液压入电池堆体内,在机械动力作用下,使其在不同的储液罐和半电池的闭合回路中循环流动,采用质子交换膜作为电池组的隔膜,电解质溶液流过电极表面并发生电化学反应,进行充电和放电。下图为全钒液流电池放电示意图:

下列说法正确的是( )
A.放电时正极反应为:![]()
B.充电时阴极反应为:![]()
C.放电过程中电子由负极经外电路移向正极,再由正极经电解质溶液移向负极
D.该电池的储能容量,可以通过增大电解液存储罐的容积并增加电解液的体积来实现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】麦考酚酸是一种有效的免疫抑制剂,能有效地防止肾移植排斥,其结构简式如图所示。下列有关麦考酚酸说法正确的是( )
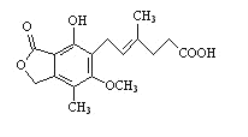
A.分子式为C17H22O6
B.能与FeC13溶液发生显色反应
C.1mol麦考酚酸最多能与2molNaHCO3反应
D.1mol麦考酚酸最多能与3molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴乙烷是一种重要的有机化工原料,其沸点为38.4℃。制备溴乙烷的一种方法是乙醇与氢溴酸反应。
(1)该反应的化学方程式是:___。
实际通常是用溴化钠与一定浓度的硫酸和乙醇反应.某课外小组欲在实验室制备溴乙烷的装置如图。
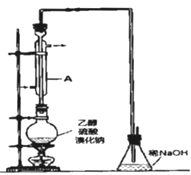
实验操作步骤如下:
①检查装置的气密性;
②在圆底烧瓶中加入95%乙醇、80%硫酸,然后加入研细的溴化钠粉末和几粒碎瓷片;
③小心加热,使其充分反应.
请问答下列问题:
(2)装置A的作用是__。
(3)反应时若温度过高,观察到还有一种红棕色气体(Br2)产生,反应结束后,得到的粗产品呈棕黄色。为了除去粗产品中的杂质,可选择下列试剂中的____(填写上正确选项的字母)。
a.稀氢氧化钠溶液 b.乙醇 c.四氯化碳 d.Na2SO3溶液
(4)要进一步制得纯净的溴乙烷,可继续用蒸馏水洗涤,分液后,再加入无水CaCl2,然后进行的实验操作是____(填写正确选项的字母)。
a.分液 b.蒸馏 c.萃取
(5)为了检验溴乙烷中含有溴元素,不能直接向溴乙烷中滴加硝酸银溶液来检验,通常采用的方法是取少量溴乙烷,然后___(按实验的操作顺序选填下列序号).
①加热 ②加入AgNO3溶液 ③加入稀HNO3酸化 ④加入NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是原子序数依次增大的四种短周期主族元素,X与Y位于同一主族,X与W能够形成多种化合物,其中一种为红棕色气体,Y与Z形成的一种化合物Y2Z2的分子结构模型为![]() 。下列叙述正确的是( )
。下列叙述正确的是( )
A.X与W、Y及Z均能组合成多种化合物B.简单离子半径:Y>Z>X>W
C.W的氧化物的水化物一定为强酸D.化合物Y2Z2中Y不满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒压、NO和O2的起始浓度一定的条件下发生反应,在相同时间内,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法不正确的是( )

A.反应2NO(g) + O2(g) = 2NO2(g)的H<0
B.图中X点所示条件下,由于测定时间较短,反应未达到平衡
C.从 X→Y 过程中,平衡逆向移动,O2反应量减少
D.380℃下,c 平衡(O2)=5.0×104 mol·L1,NO 平衡转化率为 50%,则平衡常数 K=2000
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚邻苯二甲酸二烯丙酯(β聚合物)是一种优良的热固性树脂,这种材料可以采取下列路线合成:

已知:![]()
(1)反应类型:反应①___;反应⑤___。
(2)写出有关反应的方程式:
②__;④__。
(3)G是E的同分异构体,G具有如下性质:
①能发生银镜反应且1molG与银氨溶液反应时最多可得到4molAg;
②遇FeCl3溶液呈紫色;③能够发生水解反应;
符合上述条件的G最多有__种,写出其中苯环上取代基位置均相邻的所有可能的结构简式:___。
(4)工业上可由A为原料经过三步反应制得甘油(![]() ),根据已有知识并结合相关信息,表示出这一合成过程___。
),根据已有知识并结合相关信息,表示出这一合成过程___。
合成路线流程图示例如下:CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3COOCH2CH3。
CH3COOCH2CH3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列叙述正确的是( )
A.18g H216O 和20g H218O 含有的质子数均为10NA
B.1L 1mol/L的KAl(SO4)2 溶液中阳离子总数为2NA
C.0.2mol的铁与足量的稀硝酸反应,生成氢气的分子数目为0.3NA
D.反应N2+3H2 ![]() 2NH3 达平衡时,每消耗3molH2同时有2NA 个N-H 键断裂
2NH3 达平衡时,每消耗3molH2同时有2NA 个N-H 键断裂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com