
【题目】恒压、NO和O2的起始浓度一定的条件下发生反应,在相同时间内,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法不正确的是( )

A.反应2NO(g) + O2(g) = 2NO2(g)的H<0
B.图中X点所示条件下,由于测定时间较短,反应未达到平衡
C.从 X→Y 过程中,平衡逆向移动,O2反应量减少
D.380℃下,c 平衡(O2)=5.0×104 mol·L1,NO 平衡转化率为 50%,则平衡常数 K=2000
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】[化学—选修3;物质结构与性质]
明朝《天工开物》中有世界上最早的关于炼锌技术的记载,锌也是人体必需的微量元素。回答下列问题:
(1)基态Zn原子核外的最高能层符号是________,基态Zn2+最外层电子排布式为________。
(2)硫酸锌溶于氨水形成[Zn(NH3)4]SO4溶液。
①组成[Zn(NH3)4]SO4的元素中,除Zn外其余元素的电负性由大到小排序为________。
②向[Zn(NH3)4]SO4溶液中逐滴滴加NaOH溶液,未出现浑浊,其原因是________。
③已知[Zn(NH3)4]2+的空间构型与![]() 相同,则在[Zn(NH3)4]2+中Zn2+的杂化类型为________,NH3易液化的原因是________________________________。
相同,则在[Zn(NH3)4]2+中Zn2+的杂化类型为________,NH3易液化的原因是________________________________。
④在[Zn(NH3)4]SO4晶体中存在的作用力有________。
A.离子键 B.极性共价键 C.氢键
D.配位键 E.范德华力 F.金属键
(3)ZnO与ZnS结构相似,ZnO的熔点为1975℃,ZnS的熔点约为1700℃。ZnO熔点比ZnS高的原因是________________________________。
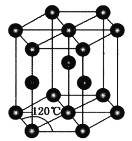
(4)常温下金属锌晶体的晶胞为六方最密堆积(如图所示),若锌原子的半径为rnm,六棱柱的高为![]() ,则金属锌晶体的空间利用率是________(用含π的代数式表示)。
,则金属锌晶体的空间利用率是________(用含π的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由合成气制备二甲醚,涉及如下反应:
(i)2CH3OH(g)![]() C2H4(g)+2H2O(g) ΔH1
C2H4(g)+2H2O(g) ΔH1
(ii)2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH2
CH3OCH3(g)+H2O(g) ΔH2
能量变化如图所示:
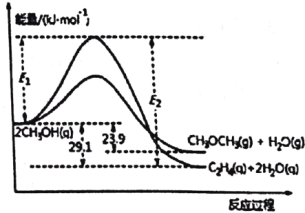
下列说法正确的是
A. ΔH1<ΔH2
B. 反应(ii)为吸热反应
C. C2H4(g)+H2O(g)![]() CH3OCH3(g) ΔH = -5.2 kJ·mol-1
CH3OCH3(g) ΔH = -5.2 kJ·mol-1
D. 若在容器中加入催化剂,则E2-E1将变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应叙述相符合的是( )

A.图1表示在含等物质的量NaOH、![]() 的混合溶液中滴加
的混合溶液中滴加![]() 盐酸至过量时,产生气体的体积与消耗盐酸的关系
盐酸至过量时,产生气体的体积与消耗盐酸的关系
B.图2表示![]() 通入
通入![]() 溶液中pH的变化
溶液中pH的变化
C.图3表示![]() 酸性溶液与过量的
酸性溶液与过量的![]() 溶液混合时,
溶液混合时,![]() 随时间的变化
随时间的变化![]() 对该反应有催化作用
对该反应有催化作用![]()
D.图4表示已达平衡的某可逆反应,在![]() 时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂
时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能证明醋酸是弱酸的是( )
A.常温下,测得醋酸钠溶液的![]()
B.醋酸可以使紫色石蕊试液变红
C.物质的量浓度相同时,锌粒跟盐酸反应的速率比与醋酸反应的快
D.常温下,测得![]()
![]() 醋酸溶液的
醋酸溶液的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各离子①H+ ②Cl- ③Al3+ ④K+ ⑤S2- ⑥OH- ⑦NO3- ⑧NH4+中,不影响水的电离平衡的是( )
A.①③⑤⑦⑧B.②④⑦C.①⑥D.②④⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列四幅图象与对应描述相符合的是( )
A.![]() 反应中
反应中![]() 的平衡转化率随温度和压强的变化
的平衡转化率随温度和压强的变化
B. 酸性高锰酸钾溶液与草酸反应时
酸性高锰酸钾溶液与草酸反应时![]() 的反应速率随时间变化的图象
的反应速率随时间变化的图象
C.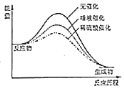 不同催化剂对淀粉水解反应影响的“能量
不同催化剂对淀粉水解反应影响的“能量![]() 反应历程”图象
反应历程”图象
D. 烧碱溶液滴定20mL等浓度醋酸时pH随加入烧碱溶液体积变化的图象
烧碱溶液滴定20mL等浓度醋酸时pH随加入烧碱溶液体积变化的图象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活污水中的氮和磷主要以铵盐和磷酸盐形式存在,可用电解法从溶液中去除。电解装置如图:

以铁作阴极、石墨作阳极,可进行除氮;翻转电源正负极,以铁作阳极、石墨作阴极,可进行除磷。
I.电解除氮
(1)在碱性溶液中,NH3能直接在电极放电,转化为N2,相应的电极反应式为:_______。
(2)有Cl-存在时,除氮原理如图所示

主要依靠有效氯(HClO、ClO-)将NH4+ 或NH3氧化为N2。在不同pH条件下进行电解时,氮的去除率和水中有效氯浓度如图:

①当pH<8时,主要发生HClO氧化NH4+ 的反应,其离子方程式为:____________。
②结合平衡移动原理解释,当pH<8时,氮的去除率随pH的降低而下降的原因是:_____。
II.电解除磷
(3)除磷的原理是利用Fe2+ 将PO43- 转化为Fe3(PO4)2沉淀。
如图为某含Cl- 污水在氮磷联合脱除过程中溶液pH的变化。推测在20-40 min时脱除的元素是________。

(4)测定污水磷含量的方法如下:取100mL污水,调节至合适pH后用AgNO3溶液使磷全部转化为Ag3PO4沉淀。将沉淀过滤并洗涤后,用硝酸溶解,再使用NH4SCN溶液滴定产生的Ag+,发生反应Ag++SCN-=AgSCN↓,共消耗c mol/LNH4SCN溶液V mL。则此污水中磷的含量为_________mg/L(以磷元素计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如下:
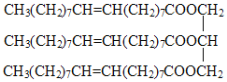
试回答下列问题。
(1)有机物属于________(填序号,下同)。
A.烯烃 B.酯 C.油脂 D.酸
(2)该有机物的密度________。
A.比水大 B.比水小
(3)该有机物在常温下呈________。
A.液态 B.固态 C.气态
(4)与该有机物能发生反应的物质有________。
A.![]() 溶液 B.溴水 C.乙酸 D.H2
溶液 B.溴水 C.乙酸 D.H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com