
����Ŀ���ɺϳ����Ʊ������ѣ��漰���·�Ӧ��
��i��2CH3OH(g)![]() C2H4(g)+2H2O(g) ��H1
C2H4(g)+2H2O(g) ��H1
��ii��2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ��H2
CH3OCH3(g)+H2O(g) ��H2
�����仯��ͼ��ʾ��
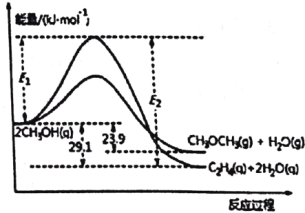
����˵����ȷ����
A. ��H1����H2
B. ��Ӧ��ii��Ϊ���ȷ�Ӧ
C. C2H4(g)+H2O(g)![]() CH3OCH3(g) ��H = -5.2 kJ��mol��1
CH3OCH3(g) ��H = -5.2 kJ��mol��1
D. ���������м����������E2-E1����С
���𰸡�A
��������
A. ����ͼ�����ݿ�֪����Ӧ�����з���Խ�࣬���Ӧ�ķ�Ӧ����HԽС��
B. ��Ӧ����������������������������
C. ���ݸ�˹���ɷ�������
D. �������Խ��ͷ�Ӧ�Ļ�ܣ������ı䷴Ӧ�ȣ�
A. ����ͼ�����ݿ�֪����H1 = -29.1 kJ��mol��1����H2 = -23.9 kJ��mol��1������H1����H2����A����ȷ��
B. ��ͼ�����ݿɿ�������H2��0������Ӧ��ii��Ϊ���ȷ�Ӧ����B�����
C. ���ݸ�˹���ɿ�֪����Ӧ��ii��-��Ӧ��i���ɵ÷�ӦC2H4(g)+H2O(g)![]() CH3OCH3(g)������H = ��H2-��H1 = -23.9 kJ��mol��1-��-29.1 kJ��mol��1��= +5.2 kJ��mol��1����C�����
CH3OCH3(g)������H = ��H2-��H1 = -23.9 kJ��mol��1-��-29.1 kJ��mol��1��= +5.2 kJ��mol��1����C�����
D. ���������м�������������˷�Ӧ�Ļ�ܣ�������ı䷴Ӧ�ʱ䣬��E2-E1�IJ�ֵ���䣬��D�����
��ѡA��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ӻ�ˮ����ȡ�������ʵĹ�������ͼ��ʾ

�����й�˵���������
A. ���̢���Ҫ���뻯ѧ�Լ������������˵Ȳ���
B. ����ĸҺ����ˮMgCl2��һϵ�б仯��δ�漰������ԭ��Ӧ
C. ��ҵ��һ���ý���������ˮMgCl2��Ӧ��ȡMg����
D. ��Ӧ�ۺ͢ݾ��������з�Ӧʵ�֣�2Br-+Cl2=Br2+2Cl-���÷�Ӧ�����û���Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С���ô�п������������ˮ�Ҳ����ᷴӦ����100gϡ���ᷴӦʱ��ʵ���������±���ʾ��
ʵ����� | ��п����/g | ϡ��������/g | ������������/g | ��Ӧ��ʣ���������/g |
ʵ��1 | 8 | 100 | 0.2 | 1.5 |
ʵ��2 | 16 | 100 | 0.4 | 3 |
ʵ��3 | 30 | 100 | 0.6 | 10.5 |
��1��ʵ����ϡ���ᷴӦ�����______����ʵ����ţ���
��2������ϡ�����������������______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���� 2 L���ܱ�������, ���� 1 mol N2 �� 3 mol H2, ��һ���������·�Ӧ, 2 ���Ӻ�ﵽƽ��״̬, ��ͬ�¶���, ���ƽ��ʱ��������ѹǿ�ȷ�Ӧǰ��������ѹǿ��С�� 1/10, ��:
(1) ƽ��ʱ���������������������ʵ�����Ϊ����______��
(2) N2 ��ת����Ϊ���� _____��
(3) ���¶��µ�ƽ�ⳣ��Ϊ����_____ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�����ܱ������г���2 mol SO2��1mol O2����һ�������·�����Ӧ��2SO2��O2![]() 2SO3�������й�˵����ȷ����
2SO3�������й�˵����ȷ����
A. �ﵽ��ѧƽ��ʱ������Ӧ���淴Ӧ�����ʶ�Ϊ��
B. ��O2��Ũ�Ȳ���ʱ����Ӧ�ﵽƽ��״̬
C. ����λʱ������a mol O2��ͬʱ����2a mol SO2ʱ����Ӧ�ﵽƽ��״̬
D. ��SO2��O2��SO3�ķ�������Ϊ2��1��2����Ӧ�ﵽƽ��״̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ������װ�ý����й�Cl2��ʵ�顣����˵������ȷ���ǣ� ��
A.  ͼ�У�ʵ������֤��������Ư�����ã���ˮ��Ư������
ͼ�У�ʵ������֤��������Ư�����ã���ˮ��Ư������
B.  ͼ�У��ռ�����
ͼ�У��ռ�����
C.  ͼ�У������ػ�ɫ���̣�������ˮ�ܽ�õ�����ɫ��Һ
ͼ�У������ػ�ɫ���̣�������ˮ�ܽ�õ�����ɫ��Һ
D.  ͼ�У�������ɱ�֤������NaOH��Һ��Ӧ
ͼ�У�������ɱ�֤������NaOH��Һ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��B��C��D���ֳ����Ľ������ʣ�AԪ���ڵؿ��к���λ�е�6��A���ܶ�Ϊ0.97 g/cm3��BΪ�Ϻ�ɫ���壬��ʴʱ��Ϊ��ɫ��C�ڿ����м����ڻ��������䣻D������ȼ�գ��������䡣����������Ϣ�ش��������⣺д����Ӧ��ѧʽ��
(1)A����������������Ӧ����______��D�ڿ�������ʴ���ɵ�������Ϊ_____��
(2)д�����л�ѧ����ʽ��
��A�ڿ�����ȼ��_______________��
��B�������ڿ����б����ɫ����_________��
(3)��5 g�����Ͻ�Ͷ��200 mL��ˮ�У�������ȫ�ܽ⣬����4.48 L��״̬�µ����壬��Һ��ֻ��һ�����ʡ����������ó������Ͻ������ֽ��������ʵ���֮��Ϊ______��������Һ�����ʵ����ʵ���Ũ��Ϊ_____(������Һ����仯���Բ���)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ֱ�ȡ����Ϊa g��Fe2O3��CuO�Ļ�Ϲ����ĩ����������ʵ�飺
��1�������ĩ�ڼ�����������������CO��ԭ���õ����������b g�������ɵ�CO2�����������ij���ʯ��ˮ���պ���c g��ɫ��������a = ________g���ú�b��c�Ĵ���ʽ��ʾ����
��2�������ĩ������������������������ۣ�������Һ�еĽ�������ֻ��Fe2+��ͬʱ�ռ���224 mL H2����״���£�������ȥ0.03 mol���ۡ���ԭ�������Fe2O3�����ʵ�����________���ú�a�Ĵ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ�¼���������ͼ��������ⲻ��Ӧ���ǣ� ��
A.ij�غ����м���������˾���Ƶĺ�ˮ����Ĥ������Դ����
B.ijϴ�»������Ʋ���ϴ�·۵�ϴ�»�������Ⱦ����
C.����Ӧ���ڼ��������ĵ������ϡ�����Դ����
D.�п�Ժ���Ƶ����ײ������ڹ��Ҵ��Ժ������������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com