
【题目】从海水中提取部分物质的过程如下图所示

下列有关说法错误的是
A. 过程①需要加入化学试剂、沉淀、过滤等操作
B. 由“母液→无水MgCl2”一系列变化中未涉及氧化还原反应
C. 工业上一般用金属钠与无水MgCl2反应制取Mg单质
D. 反应③和⑤均可由下列反应实现:2Br-+Cl2=Br2+2Cl-,该反应属于置换反应
【答案】C
【解析】
A.过程①在粗盐中含有CaCl2、MgCl2、Na2SO4等杂质,需要加入化学试剂Na2CO3、BaCl2、NaOH等化学试剂把杂质沉淀过滤除去,再加入HCl调节溶液的pH,就得到精盐溶液,可以用于氯碱工业,正确;
B.母液中含有MgCl2,将溶液在HCl的氛围中加热就可以得到无水MgCl2,在这一系列变化中元素的化合价没有变化,因此未涉及氧化还原反应,正确;
C.工业上一般电解无水MgCl2反应制取Mg单质,错误;
D.反应③和⑤均可由下列反应实现:2Br-+Cl2=Br2+2Cl-,该反应是单质与化合物反应产生新的单质和新的化合物,因此都属于置换反应,正确。
答案选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述正确的是

A. a和b不连接时,铁片上不会有金属铜析出
B. 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
C. a和b用导线连接时,电流方向从b到a
D. a和b用导线连接时,Fe片上发生氧化反应,溶液中SO42-向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制备氮化硅的反应为:3SiCl4(g)+2N2(g)+6H2(g)![]() Si3N4(s)+12HCl(g) ΔH<0,将0.3 molSiCl4 和一定量 N2、H2 投入2 L反应容器,只改变温度条件测得Si3N4的质量变化如下表:
Si3N4(s)+12HCl(g) ΔH<0,将0.3 molSiCl4 和一定量 N2、H2 投入2 L反应容器,只改变温度条件测得Si3N4的质量变化如下表:
时间/min 质量/g 温 度/℃ | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
250 | 0.00 | 1.52 | 2.80 | 3.71 | 4.73 | 5.60 | 5.60 |
300 | 0.00 | 2.13 | 3.45 | 4.48 | 4.48 | 4.48 | 4.48 |
下列说法正确的是
A. 250℃,前 2min, Si3N4 的平均反应速率为 0.02 mol·L-1·min-1
B. 反应达到平衡时, 两种温度下 N2 和 H2 的转化率之比相同
C. 达到平衡前, 300℃条件的反应速率比 250℃快; 平衡后, 300℃比 250℃慢
D. 反应达到平衡时, 两种条件下反应放出的热量一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式书写错误的是( )
A. Na2CO3+2HCl= 2NaCl+H2O+CO2↑B. CO2+Ca(OH)2=CaCO3↓+H2O
C. CuSO4+ BaOH=CuOH↓+BaSO4D. 3CO+Fe2O3![]() 2Fe+3CO2
2Fe+3CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应在任何温度下均能自发进行的是
A. 2N2(g)+O2(g)===2N2O(g) ΔH=+163 kJ·mol-1
B. Ag(s)+Cl2(g)===AgCl(s) ΔH=-127 kJ·mol-1
C. HgO(s)===Hg(l)+O2(g) ΔH=+91 kJ·mol-1
D. H2O2(l)===O2(g)+H2O(l) ΔH=-98 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按下图所示装置进行实验,并回答下列问题:

(1)装置的名称:A池为_____________,B池为__________(填电解池、原电池)。
(2)石墨棒C1为________极,电极反应式为________________________________。石墨棒C2附近发生的实验现象_________________________________________________________。反应结束后,B池溶液的pH值________。(增大、减小、不变,忽略气体溶于水) 。
(3)当C2极析出2.24L气体(标准状况下),锌的质量________(增加或减少)________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2通过下列工艺流程可制化工业原料H2SO4和清洁能源H2。
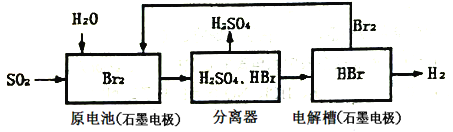
下列说法中错误的是
A. 电解槽中不能用铁电极代替石墨作为阳极
B. 原电池中负极的电极反应为:SO2+2H2O-2e-=SO42-+4H+
C. 该工艺流程用总反应的化学方程式表示为:SO2+Br2+2H2O=2HBr+H2SO4
D. 该生产工艺的优点Br2被循环利用,原电池产生的电能可充分利用,还能获得清洁能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ某实验小组同学为了探究铜与浓硫酸的反应,进行了如下实验,实验装置如图所示。实验步骤如下:

①先连接如图所示的装置,检查好气密性,再加入试剂;
②加热A试管,待B试管中品红溶液褪色后,熄灭酒精灯;
③将Cu丝向上抽动离开液面。
(1)A试管中发生反应的化学方程式为__________。
(2)能够证明铜与浓硫酸反应生成气体的实验现象是_____。
(3)在盛有BaCl2溶液的C试管中,除了导管口有气泡外,无其他明显现象,若将实验后的溶液分成两份,分别滴加氯水和氨水,均产生白色沉淀。写出其中SO2表现还原性的离子反应方程式为_____。
(4)下列对导管E作用的分析中正确的是__________。
A 加热过程中,可上下移动导管E,起搅拌作用
B 停止加热,试管内的压强减少,从导管E进入的空气可增大试管A内的压强,防止倒吸
C 停止反应,撤装置之前往导管E中通入空气,可排出装置内的SO2气体,防止其污染环境
II ClO2与Cl2的氧化性相近,可用于自来水消毒和果蔬保鲜等方面。某兴趣小组通过图1装置(夹持装置略)对ClO2的制备、除杂、吸收和释放等进行了研究。

(1)仪器B的名称是________。打开B的活塞,A中发生反应为:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O,为使ClO2在D中被稳定剂充分吸收,滴加B中稀盐酸的速度宜______(填“快”或“慢”)。
(2)关闭B的活塞,ClO2在D中被某种稳定剂完全吸收生成NaClO2,此时F中溶液颜色不变,则装置C的作用是____。
(3)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为_____;在ClO2释放实验中,打开E的活塞,D中发生反应,则此时装置F的作用是_____。安装F中导管时,应选用图2中的____(填“a”或“b”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由合成气制备二甲醚,涉及如下反应:
(i)2CH3OH(g)![]() C2H4(g)+2H2O(g) ΔH1
C2H4(g)+2H2O(g) ΔH1
(ii)2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH2
CH3OCH3(g)+H2O(g) ΔH2
能量变化如图所示:
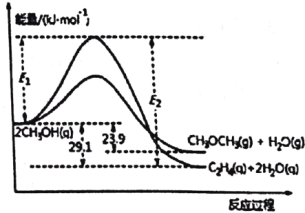
下列说法正确的是
A. ΔH1<ΔH2
B. 反应(ii)为吸热反应
C. C2H4(g)+H2O(g)![]() CH3OCH3(g) ΔH = -5.2 kJ·mol-1
CH3OCH3(g) ΔH = -5.2 kJ·mol-1
D. 若在容器中加入催化剂,则E2-E1将变小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com