
【题目】工业制备氮化硅的反应为:3SiCl4(g)+2N2(g)+6H2(g)![]() Si3N4(s)+12HCl(g) ΔH<0,将0.3 molSiCl4 和一定量 N2、H2 投入2 L反应容器,只改变温度条件测得Si3N4的质量变化如下表:
Si3N4(s)+12HCl(g) ΔH<0,将0.3 molSiCl4 和一定量 N2、H2 投入2 L反应容器,只改变温度条件测得Si3N4的质量变化如下表:
时间/min 质量/g 温 度/℃ | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
250 | 0.00 | 1.52 | 2.80 | 3.71 | 4.73 | 5.60 | 5.60 |
300 | 0.00 | 2.13 | 3.45 | 4.48 | 4.48 | 4.48 | 4.48 |
下列说法正确的是
A. 250℃,前 2min, Si3N4 的平均反应速率为 0.02 mol·L-1·min-1
B. 反应达到平衡时, 两种温度下 N2 和 H2 的转化率之比相同
C. 达到平衡前, 300℃条件的反应速率比 250℃快; 平衡后, 300℃比 250℃慢
D. 反应达到平衡时, 两种条件下反应放出的热量一样多
【答案】B
【解析】
由表格数据可知,250℃时,反应在5min达到化学平衡,300℃时,反应在3 min达到化学平衡。
A、Si3N4为固体,固体的浓度为定值;
B、起始N2和H2的物质的量比值为定值,反应中N2和H2的消耗量的比值恒定为1:3;
C、其他条件相同时,升高温度,反应速率加快;
D、该反应为放热反应,升高温度平衡逆向移动,温度不同,反应物的消耗量不同。
A项、Si3N4为固体,固体的浓度为定值,不能用固体表示化学反应速率,A错误;
B项、起始N2和H2的物质的量比值为定值,反应中N2和H2的消耗量的比值恒定为1:3,则反应达到平衡时, 两种温度下N2和H2的转化率之比相同,B正确;
C项、其他条件相同时,升高温度,反应速率加快,温度越高,反应速率越大,则达到平衡前,300℃条件的反应速率比250℃快,平衡后,300℃依然比250℃快,C错误;
D项、该反应为放热反应,升高温度平衡逆向移动,温度不同,反应物的消耗量不同,则反应放出的热量不同,D错误。


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】低碳经济成为人们一种新的生活理念,二氧化碳的捕捉和利用是能源领域的一个重要研究方向。请你结合下列有关图示和所学知识回答:
I.用CO2催化加氢可以制取乙烯:CO2(g)+3H2(g)![]() 1/2C2H4(g)+2H2O(g)。
1/2C2H4(g)+2H2O(g)。
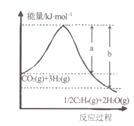
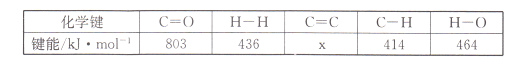
(l)若该反应体系的能量随反应过程变化关系如图所示,则该反应△H =___________(用含a、b的式子表示);又知:相关化学键的键能如下表所示,实验测得上述反应的△H =-152 kJ/mol,则表中的x= ___。
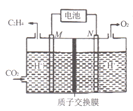
(2)以稀硫酸为电解质溶液,利用太阳能电池将CO2转化为乙烯的工作原理如图所示。则M极上的电极反应式为____。
II.用CO2催化加氢还可以制取二甲醚:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)△H =-122.5kJ/mol,某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的平衡转化率如图所示。
CH3OCH3(g)+3H2O(g)△H =-122.5kJ/mol,某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的平衡转化率如图所示。
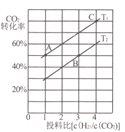
(3)图中T1、T2分别表示反应温度,判断T1、T2大小关系的依据是____;图中A、B、C三点对应的平衡常数分别为KA、KB、Kc,其三者大小的关系是____。
(4)T1温度下,将6molCO2和12molH2充入2L的密闭容器中,经过5min反应达到平衡,则0~5min内的平均反应速率υ(H2)=_______,平衡常数K=__(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对利用甲烷消除NO2污染进行研究,CH4+2NO2![]() N2+CO2+2H2O。在1 L密闭容器中,控制不同温度,分别加入0.50 mol CH4和1.2 mol NO2,测得n(CH4)随时间变化的有关实验数据见下表。
N2+CO2+2H2O。在1 L密闭容器中,控制不同温度,分别加入0.50 mol CH4和1.2 mol NO2,测得n(CH4)随时间变化的有关实验数据见下表。

下列说法正确的是
A. 由实验数据可知实验控制的温度T1<T2
B. 020 min内,CH4的降解速率:②>①
C. 40 min时,表格中T1对应的数据为0.18
D. 组别②中,010 min内,NO2的降解速率为0.0300 mol·L-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入一定量SO2、O2发生反应2SO2(g)+O2(g)![]() 2SO3(g), 测得SO3浓度与反应温度关系如图.下列说法正确的是
2SO3(g), 测得SO3浓度与反应温度关系如图.下列说法正确的是

A. 该反应△H>0 B. SO2转化率:a>b>c
C. 化学反应速率:c>b>a D. 平衡常数K:b>c>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g)![]() 3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是
3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是
A. 2.5mol C B. 2 mol A、2 mol B和10 mol He(不参加反应)
C. 1.5 mol B和1.5 mol C D. 2 mol A、3 mol B和3 mol C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组在同样的实验条件下,用同样的实验仪器和方法步骤进行两组中和热测定的实验,实验试剂及其用量如表所示。
反应物 | 起始温度/℃ | 终了温度/℃ | 中和热/ kJ·mol-1 | |
硫酸 | 碱溶液 | |||
①0.5 mol·L-1 H2SO4溶液50 mL、1.1 mol·L-1 NaOH溶液50 mL | 25.1 | 25.1 | ΔH1 | |
②0.5 mol·L-1 H2SO4溶液50 mL、1.1 mol·L-1 NH3·H2O溶液50 mL | 25.1 | 25.1 | ΔH2 | |
(1)实验①中碱液过量的目的是____________________。
(2)甲同学预计ΔH1≠ΔH2,其依据是______________________。
(3)若实验测得①中终了温度为31.8 ℃,则该反应的中和热ΔH1=________(已知硫酸、NaOH溶液密度近似为1.0 g·cm-3,中和后混合液的比热容c=4.18×10-3 kJ·g-1·℃-1)。
(4)在中和热测定实验中,若测定硫酸的温度计未用水洗涤就直接测量碱溶液的温度,则测得的中和热ΔH________(填“偏大”“偏小”或“不变”,下同)。
(5)若实验①中硫酸用盐酸代替,且中和反应时有少量HCl挥发,则测得中和反应过程中放出的热量Q________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.l0mol/LKOH溶液滴定10.00mL 0.10mol/LH2C2O4(二元弱酸)溶液所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和)。下列说法正确的是
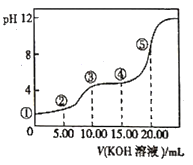
A. 点①所示溶液中![]() =1012
=1012
B. 点②所示溶液中:c(K+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-)
C. 点③所示溶液中:c(K+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
D. 点④所示溶液中:c(K+)+ c(H2C2O4)+ c(HC2O4-)+ c(C2O42-)=0.10mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取部分物质的过程如下图所示

下列有关说法错误的是
A. 过程①需要加入化学试剂、沉淀、过滤等操作
B. 由“母液→无水MgCl2”一系列变化中未涉及氧化还原反应
C. 工业上一般用金属钠与无水MgCl2反应制取Mg单质
D. 反应③和⑤均可由下列反应实现:2Br-+Cl2=Br2+2Cl-,该反应属于置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用粗锌(杂质难溶于水且不与酸反应)与100g稀硫酸反应时,实验数据如下表所示:
实验序号 | 粗锌质量/g | 稀硫酸质量/g | 生成气体质量/g | 反应后剩余固体质量/g |
实验1 | 8 | 100 | 0.2 | 1.5 |
实验2 | 16 | 100 | 0.4 | 3 |
实验3 | 30 | 100 | 0.6 | 10.5 |
(1)实验中稀硫酸反应完的是______(填实验序号);
(2)计算稀硫酸的溶质质量分数______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com