
【题目】某小组为研究电化学原理,设计如图装置。下列叙述正确的是

A. a和b不连接时,铁片上不会有金属铜析出
B. 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
C. a和b用导线连接时,电流方向从b到a
D. a和b用导线连接时,Fe片上发生氧化反应,溶液中SO42-向铜电极移动
【答案】B
【解析】
A.由于金属活动性Fe>Cu,所以a和b不连接时,铁片上发生反应:Fe+CuSO4=FeSO4+Cu,所以Fe片上会有金属铜析出,A错误;
B.若a、b不连接,在Fe片上会发生反应Fe+CuSO4=FeSO4+Cu,铁片均会溶解,溶液从蓝色逐渐变成浅绿色;若a、b连接,构成原电池,在Fe片上发生反应:Fe-2e-=Fe2+,在Cu片上发生反应:Cu2++2e-=Cu,总反应方程式Fe+Cu2+=Fe2++Cu,看到的仍然是铁片均会溶解,溶液从蓝色逐渐变成浅绿色,B正确;
C.若a和b用导线连接时,构成原电池,由于金属活动性:Fe>Cu,所以Fe为负极,失去电子,因此电子从b到a,而电流方向从a到b,C错误;
D. a和b用导线连接时,Fe片为负极,失去电子发生氧化反应,溶液中SO42-向正电荷较多的负极铁电极移动,D错误;
故合理选项是B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是

A. 25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)将减小
B. 一定温度下,反应“2HI(g)![]() H2(g)+I2(g) △H>0”能自发进行,则该反应△S>0
H2(g)+I2(g) △H>0”能自发进行,则该反应△S>0
C. 向滴有酚酞的Na2CO3溶液中滴加BaCl2溶液,红色逐渐褪去,说明BaCl2溶液显酸性
D. 上图电池放电时的正极反应式:2Li++Li2O2+2e—=2Li2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】低碳经济成为人们一种新的生活理念,二氧化碳的捕捉和利用是能源领域的一个重要研究方向。请你结合下列有关图示和所学知识回答:
I.用CO2催化加氢可以制取乙烯:CO2(g)+3H2(g)![]() 1/2C2H4(g)+2H2O(g)。
1/2C2H4(g)+2H2O(g)。
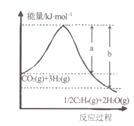
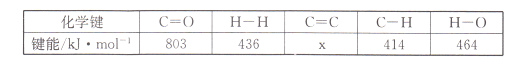
(l)若该反应体系的能量随反应过程变化关系如图所示,则该反应△H =___________(用含a、b的式子表示);又知:相关化学键的键能如下表所示,实验测得上述反应的△H =-152 kJ/mol,则表中的x= ___。
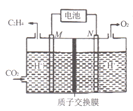
(2)以稀硫酸为电解质溶液,利用太阳能电池将CO2转化为乙烯的工作原理如图所示。则M极上的电极反应式为____。
II.用CO2催化加氢还可以制取二甲醚:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)△H =-122.5kJ/mol,某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的平衡转化率如图所示。
CH3OCH3(g)+3H2O(g)△H =-122.5kJ/mol,某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的平衡转化率如图所示。
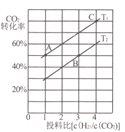
(3)图中T1、T2分别表示反应温度,判断T1、T2大小关系的依据是____;图中A、B、C三点对应的平衡常数分别为KA、KB、Kc,其三者大小的关系是____。
(4)T1温度下,将6molCO2和12molH2充入2L的密闭容器中,经过5min反应达到平衡,则0~5min内的平均反应速率υ(H2)=_______,平衡常数K=__(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知七种短周期元素a~g的有关信息如下表所示:
元素编号 | a | b | c | d | e | f | g |
原子半径/nm | 0.037 | 0.074 | 0.082 | 0.102 | 0.143 | 0.152 | 0.186 |
最高化合价或最低化合价 | +1 | ﹣2 | +3 | ﹣2 | +3 | +1 | +1 |
下列推断不正确的是( )
A. 氢化物稳定性的强弱:b>dB. 金属性的强弱:f<g
C. 元素e的氧化物只能与酸反应D. 元素a与元素d形成的化合物属于共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时有关弱酸的电离平衡常数:
弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 | H2SO3 |
电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.3×10-2 K2=6.3×10-8 |
(1)25℃时,将20mL 0.1mol·L-1CH3COOH溶液和20mL 0.1mol·L-1HSCN溶液分别与20mL 0.1 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:

反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是:__________________________
(2)若保持温度不变,在CH3COOH溶液中加入一定量氨气,下列量会变小的是____(填序号)
A.c(CH3COO-) B.c(H+)C.Kw D.醋酸电离平衡常数
(3)若保持温度不变,将pH均为3的HCl与HSCN的溶液分别加水稀释100倍,此时c(Cl-)_____c(SCN-) (填“>、=、<”,后同),两溶液的导电性:HCl _______HSCN
(4)将足量的NaHSO3溶液加入Na2CO3溶液中,反应的离子方程式为___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍铜是力学、化学综合性能良好的合金,广泛应用于制造高级弹性元件。以下是从某废旧铍铜元件(含BeO25%、CuS71%、少量FeS和SiO2)中回收铍和铜两种金属的流程。
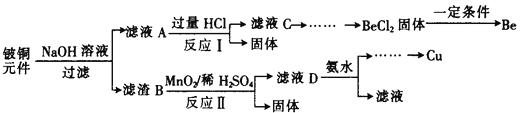
已知:I.铍、铝元素处于周期表中的对角线位置,化学性质相似
Ⅱ.常温下:Ksp[Cu(OH)2]=2.2×10![]() Ksp[Fe(OH)3]=4.0×10
Ksp[Fe(OH)3]=4.0×10![]() Ksp[Mn(OH)2]=2.1×10
Ksp[Mn(OH)2]=2.1×10![]()
(1)滤液A的主要成分除NaOH外,还有______________ (填化学式),
写出反应I中含铍化合物与过量盐酸反应的离子方程式____________________________。
(2)溶液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,选择合理步骤并排序___________。
a.加入过量的 NaOH b.通入过量的CO2 c.加入过量的氨水
d.加入适量的HCl e.过滤 f.洗涤
(3)①MnO2能将金属硫化物中的硫元素氧化为单质硫,写出反应Ⅱ中CuS发生反应的化学方程式________________________________________________________。
②若用浓HNO3溶解金属硫化物,缺点是______________ (任写一条)。
(4)溶液D中含c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可依次分离,首先沉淀的是________________ (填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH值大于______________。取铍铜元件1000g,最终获得Be的质量为81g,则产率是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对利用甲烷消除NO2污染进行研究,CH4+2NO2![]() N2+CO2+2H2O。在1 L密闭容器中,控制不同温度,分别加入0.50 mol CH4和1.2 mol NO2,测得n(CH4)随时间变化的有关实验数据见下表。
N2+CO2+2H2O。在1 L密闭容器中,控制不同温度,分别加入0.50 mol CH4和1.2 mol NO2,测得n(CH4)随时间变化的有关实验数据见下表。

下列说法正确的是
A. 由实验数据可知实验控制的温度T1<T2
B. 020 min内,CH4的降解速率:②>①
C. 40 min时,表格中T1对应的数据为0.18
D. 组别②中,010 min内,NO2的降解速率为0.0300 mol·L-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入一定量SO2、O2发生反应2SO2(g)+O2(g)![]() 2SO3(g), 测得SO3浓度与反应温度关系如图.下列说法正确的是
2SO3(g), 测得SO3浓度与反应温度关系如图.下列说法正确的是

A. 该反应△H>0 B. SO2转化率:a>b>c
C. 化学反应速率:c>b>a D. 平衡常数K:b>c>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中提取部分物质的过程如下图所示

下列有关说法错误的是
A. 过程①需要加入化学试剂、沉淀、过滤等操作
B. 由“母液→无水MgCl2”一系列变化中未涉及氧化还原反应
C. 工业上一般用金属钠与无水MgCl2反应制取Mg单质
D. 反应③和⑤均可由下列反应实现:2Br-+Cl2=Br2+2Cl-,该反应属于置换反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com