
【题目】生活污水中的氮和磷主要以铵盐和磷酸盐形式存在,可用电解法从溶液中去除。电解装置如图:

以铁作阴极、石墨作阳极,可进行除氮;翻转电源正负极,以铁作阳极、石墨作阴极,可进行除磷。
I.电解除氮
(1)在碱性溶液中,NH3能直接在电极放电,转化为N2,相应的电极反应式为:_______。
(2)有Cl-存在时,除氮原理如图所示

主要依靠有效氯(HClO、ClO-)将NH4+ 或NH3氧化为N2。在不同pH条件下进行电解时,氮的去除率和水中有效氯浓度如图:

①当pH<8时,主要发生HClO氧化NH4+ 的反应,其离子方程式为:____________。
②结合平衡移动原理解释,当pH<8时,氮的去除率随pH的降低而下降的原因是:_____。
II.电解除磷
(3)除磷的原理是利用Fe2+ 将PO43- 转化为Fe3(PO4)2沉淀。
如图为某含Cl- 污水在氮磷联合脱除过程中溶液pH的变化。推测在20-40 min时脱除的元素是________。

(4)测定污水磷含量的方法如下:取100mL污水,调节至合适pH后用AgNO3溶液使磷全部转化为Ag3PO4沉淀。将沉淀过滤并洗涤后,用硝酸溶解,再使用NH4SCN溶液滴定产生的Ag+,发生反应Ag++SCN-=AgSCN↓,共消耗c mol/LNH4SCN溶液V mL。则此污水中磷的含量为_________mg/L(以磷元素计)。
【答案】2NH3–6e-+6OH-=N2+6H2O 3HClO +2NH4+=3Cl-+N2↑+3H2O+5H+ 随溶液pH降低,c(H+)增大,Cl2 + H2O![]() H+ + Cl- +HClO平衡逆向移动,溶液中c(HClO)减小,使NH4+的氧化率下降 磷
H+ + Cl- +HClO平衡逆向移动,溶液中c(HClO)减小,使NH4+的氧化率下降 磷 ![]()
【解析】
以铁作阴极、石墨作阳极,可进行除氮;翻转电源正负极,以铁作阳极、石墨作阴极,可进行除磷,
Ⅰ.(1)在碱性溶液中,NH3能直接在电极放电,转化为N2,氮元素化合价-3价升高为0价,在阳极发生氧化反应;
(2)①当pH<8时,主要发生HClO氧化NH4+的反应生成氮气,次氯酸被还原为氯离子,结合电子守恒和电荷守恒、原子守恒书写离子反应方程式;
②pH<8时,氮的去除率随pH的降低而下降,是因为氯气和水的反应为可逆反应,PH减小,酸性增加,氢离子浓度增大,平衡逆向进行,次氯酸浓度减小;
Ⅱ.(3)②图象中开始时脱氮,转化电极后是脱磷;
(4)取100mL污水,调节至合适pH后用AgNO3溶液使磷全部转化为Ag3PO4沉淀。将沉淀过滤并洗涤后,用硝酸溶解,再使用NH4SCN溶液滴定产生的Ag+,发生反应Ag++SCN-═AgSCN↓,共消耗cmol/LNH4SCN溶液VmL.反应过程中元素守恒PO43-~Ag3PO4~3AgSCN~3NH4SCN,据此计算。
Ⅰ.(1)在碱性溶液中,NH3能直接在电极放电,转化为N2,氮元素化合价-3价升高为0价,在阳极发生氧化反应,电极反应:2NH3-6e-+6OH-=N2+6H2O;
(2)①当pH<8时,主要发生HClO氧化NH4+的反应生成氮气,次氯酸被还原为氯离子,结合电子守恒和电荷守恒、原子守恒书写离子反应方程式为:3HClO+2NH4+=3Cl-+N2+3H2O+5H+;
②当pH<8时,氮的去除率随pH的降低而下降,结合平衡移动原理解释的原因是:随溶液pH降低,c(H+)增大,Cl2+H2OH++Cl-+HClO平衡逆向移动,溶液中c(HClO)减小,使NH4+的氧化率下降,
故答案为:随溶液pH降低,c(H+)增大,Cl2+H2OH++Cl-+HClO平衡逆向移动,溶液中c(HClO)减小,使NH4+的氧化率下降;
(3)如图为某含Cl-污水在氮磷联合脱除过程中溶液pH的变化,开始时脱氮元素,翻转电极后,在20-40min时脱除的元素是磷,故答案为:磷;
(4)取100mL污水,调节至合适pH后用AgNO3溶液使磷全部转化为Ag3PO4沉淀。将沉淀过滤并洗涤后,用硝酸溶解,再使用NH4SCN溶液滴定产生的Ag+,发生反应Ag++SCN-═AgSCN↓,共消耗cmol/LNH4SCN溶液VmL.反应过程中元素守恒:P~PO43-~Ag3PO4~3AgSCN~3NH4SCN,消耗的NH4SCN物质的量为cmol/L×V×10-3L,则磷原子的物质的量为![]() ×cmol/L×V×10-3L,100mL此污水中磷的质量为
×cmol/L×V×10-3L,100mL此污水中磷的质量为![]() ×cmol/L×V×10-3L×31g/mol=
×cmol/L×V×10-3L×31g/mol=![]() cVmg,1L污水中磷的含量
cVmg,1L污水中磷的含量![]() mg。
mg。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】麦考酚酸是一种有效的免疫抑制剂,能有效地防止肾移植排斥,其结构简式如图所示。下列有关麦考酚酸说法正确的是( )
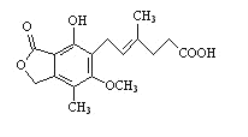
A.分子式为C17H22O6
B.能与FeC13溶液发生显色反应
C.1mol麦考酚酸最多能与2molNaHCO3反应
D.1mol麦考酚酸最多能与3molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒压、NO和O2的起始浓度一定的条件下发生反应,在相同时间内,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法不正确的是( )

A.反应2NO(g) + O2(g) = 2NO2(g)的H<0
B.图中X点所示条件下,由于测定时间较短,反应未达到平衡
C.从 X→Y 过程中,平衡逆向移动,O2反应量减少
D.380℃下,c 平衡(O2)=5.0×104 mol·L1,NO 平衡转化率为 50%,则平衡常数 K=2000
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚邻苯二甲酸二烯丙酯(β聚合物)是一种优良的热固性树脂,这种材料可以采取下列路线合成:

已知:![]()
(1)反应类型:反应①___;反应⑤___。
(2)写出有关反应的方程式:
②__;④__。
(3)G是E的同分异构体,G具有如下性质:
①能发生银镜反应且1molG与银氨溶液反应时最多可得到4molAg;
②遇FeCl3溶液呈紫色;③能够发生水解反应;
符合上述条件的G最多有__种,写出其中苯环上取代基位置均相邻的所有可能的结构简式:___。
(4)工业上可由A为原料经过三步反应制得甘油(![]() ),根据已有知识并结合相关信息,表示出这一合成过程___。
),根据已有知识并结合相关信息,表示出这一合成过程___。
合成路线流程图示例如下:CH3CH2Br![]() CH3CH2OH
CH3CH2OH![]() CH3COOCH2CH3。
CH3COOCH2CH3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前海水液化可采用双极膜电液析法、同时获得副产品,其模拟工作原理如图所示。其中双极膜(BP)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-,作为H+和OH-离子源。M、N为离子交换膜。下列说法正确的是( )

A. X电极为电解池的阴极,该电极反应式为:2H+-2e-=H2↑
B. 电子流向:电源负极→X电极→Y电极→电源正极
C. 电路中每转移1mol电子,X、Y两极共得到标准状况下16.8L的气体
D. M为阳离子交换膜,A室获得副产品NaOH;若去掉B室双极膜,B室产物不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)粗制CuSO4·5H2O晶体中常含有杂质Fe2+。
①在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质最好选用的是________。
A.KMnO4 B.H2O2 C.氯水 D.HNO3
②然后再加入适当物质调整溶液至pH=4,使Fe3+转化为Fe(OH)3,调整溶液pH可选用下列中的_______。
A.NaOH B.NH3·H2O C.CuO D.Cu(OH)2
(2)在25 ℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式),生成该沉淀的离子方程式为________。已知25 ℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
(3)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,![]() =____。已知Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10。
=____。已知Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100 ℃时,将0.40 mol二氧化氮气体充入一个2 L抽空的密闭容器中,发生反应:2NO2![]() N2O4。每隔一段时间就对该容器内的物质进行分析,得到下表数据:
N2O4。每隔一段时间就对该容器内的物质进行分析,得到下表数据:
时间/s | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
(1)在上述条件下,从反应开始至20 s时,用二氧化氮表示的平均反应速率为_______mol/(L·s)。
(2)该反应的平衡常数K的数值为____。
(3)若在相同条件下最初向该容器中充入四氧化二氮气体,要达到上述平衡状态,四氧化二氮的起始浓度是______mol·L-1。
(4)达到平衡后,如果升高温度,气体颜色会变深,则升高温度后,反应2NO2![]() N2O4的平衡常数将_________(填“增大”“减小”或“不变”)。
N2O4的平衡常数将_________(填“增大”“减小”或“不变”)。
(5)达到平衡后,如果向该密闭容器中再充入0.32 mol He,并把容器体积扩大为4 L,则平衡将_______(填“向左移动”“向右移动”或“不移动”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列叙述正确的是( )
A.18g H216O 和20g H218O 含有的质子数均为10NA
B.1L 1mol/L的KAl(SO4)2 溶液中阳离子总数为2NA
C.0.2mol的铁与足量的稀硝酸反应,生成氢气的分子数目为0.3NA
D.反应N2+3H2 ![]() 2NH3 达平衡时,每消耗3molH2同时有2NA 个N-H 键断裂
2NH3 达平衡时,每消耗3molH2同时有2NA 个N-H 键断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置进行的相应实验,能达到实验目的的是:
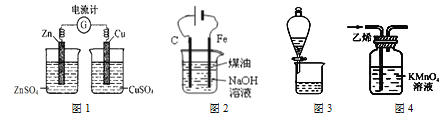
A.用图1装置用电流计检验电流的方向
B.用图2装置制备Fe(OH)2并能较长时间观察其颜色
C.用图3装置可分离CH3COOC2H5和饱和碳酸钠溶液
D.用图4装置除去C2H4中少量SO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com