
【题目】X、Y、Z、M、N、Q、P为元素周期表前四周期的7种元素。其中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1, Q在元素周期表的各元素中电负性最大。P元素的第三电子层处于全充满状态,第四电子层只有一个电子。请回答下列问题:
(1)基态X的外围电子电子排布图为_________ 。P元素属于__________ 区元素,
(2)XZ2分子的空间构型是______,YZ2分子中Y的杂化轨道类型为_____,相同条件下两者在水中的溶解度较大的是_____(写分子式),理由是_____。
(3)元素M与元素Q形成晶体中,M离子与Q离子的配位数之比为__________
(4)P单质形成的晶体中,P原子采取的堆积方式为_________
【答案】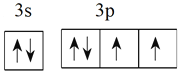 ds V形 sp SO2 SO2为极性分子,CO2为非极性分子,H2O为极性溶剂,极性分子易溶于极性溶剂,故SO2的溶解度较大 2:1 面心立方堆积
ds V形 sp SO2 SO2为极性分子,CO2为非极性分子,H2O为极性溶剂,极性分子易溶于极性溶剂,故SO2的溶解度较大 2:1 面心立方堆积
【解析】
根据核外电子排布规律及电负性等性质分析元素的种类;根据价层电子对互斥理论分析分子的空间构型及轨道杂化类型;根据分子的极性比较物质的溶解性;根据离子晶体和金属晶体的特征分析解答。
X、Y、Z、M、N、Q、P为元素周期表前四周期的7种元素,X原子核外的M层中只有两对成对电子,则X的外围电子排布式为3s23p4,则X为硫;Y原子核外的L层电子数是K层的两倍,则Y为碳;Z是地壳内含量最高的元素,则Z为氧;M的内层电子数是最外层电子数的9倍,则核外电子排布情况为2,8,8,2,则M为钙;N的原子序数比M小1,则N为钾;Q在元素周期表的各元素中电负性最大,则Q为氟;P元素的第三电子层处于全充满状态,第四电子层只有一个电子,则P原子外围电子排布为3d104s1,则P为铜;
(1)硫最外层电子数为6,所以基态原子的外围电子电子排布图为 ;P为铜元素,价电子排布式为3d104s1,所以属于ds区元素;
;P为铜元素,价电子排布式为3d104s1,所以属于ds区元素;
(2)SO2分子中S原子的价层电子对数为![]() ,S原子含有1对孤电子对,故其空间构型是V形;CO2分子为直线形,碳的杂化轨道类型为sp;SO2为极性分子,CO2为非极性分子,水为极性溶剂,根据相似相溶原理,相同条件下两者在水中的溶解度较大的是SO2;理由是SO2为极性分子,CO2为非极性分子,H2O为极性溶剂,极性分子易溶于极性溶剂,故SO2的溶解度较大;
,S原子含有1对孤电子对,故其空间构型是V形;CO2分子为直线形,碳的杂化轨道类型为sp;SO2为极性分子,CO2为非极性分子,水为极性溶剂,根据相似相溶原理,相同条件下两者在水中的溶解度较大的是SO2;理由是SO2为极性分子,CO2为非极性分子,H2O为极性溶剂,极性分子易溶于极性溶剂,故SO2的溶解度较大;
(3)CaF2为离子晶体,钙离子和氟离子个数比为1:2,则钙离子与氟离子的配位数之比为2:1;
(4)铜晶体中,原子采取的堆积方式为面心立方堆积。


科目:高中化学 来源: 题型:
【题目】对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·L-1)随时间(min)变化的有关实验数据见下表。
时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
Ⅰ(pH=2) | 0.40 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
Ⅱ(pH=4) | 0.40 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
Ⅳ(pH=4,含Cu2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
下列说法不正确的是
A. 在0~20min内,I中M的分解速率为0.015 mol·L-1·min-1
p>B. 水样酸性越强,M的分解速率越快C. 在0~25min内,III中M的分解百分率比II大
D. 由于Cu2+存在,IV中M的分解速率比I快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置进行相应实验,能达到实验目的的是

图1 图2 图3 图4
A. 图1所示装置制取并收集氨气
B. 图2所示装置用于制备并收集NO气体
C. 图3所示装置用于除去碳酸氢钠固体中的少量碳酸钠
D. 图4所示装置用于Na2CO3和稀H2SO4反应制取少量的CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理对工厂排放的废水、废渣等进行有效检测与合理处理。
某工厂对制革工业污泥中Cr元素的回收与再利用工艺如图(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+):
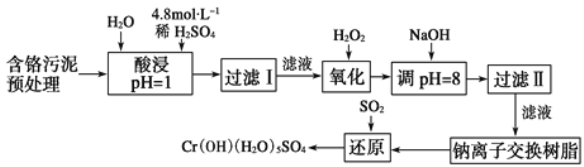
常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | - | - | - |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 9(>9溶解) |
(1) 酸浸时,为了提高浸取率可采取的措施是____(至少写两条)。
(2)H2O2的作用是_____。
(3)调pH=8是为了除去___(填Fe3+、Fe2+、Al3+、Ca2+、Mg2+)。
(4)钠离子交换树脂的原理为Mn++nNaR→MRn+nNa+,被交换的杂质离子是___(填Fe3+、Fe2+、Al3+、Ca2+、Mg2+)。
(5)已知以下氧化还原反应方程式(未配平):Na2Cr2O7+SO2+H2O=Cr(OH)(H2O)5SO4+Na2SO4;以上反应各物质的配平系数依次为___。每生成1 mol Cr(OH)(H2O)5SO4转移电子的数目为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要的化工原料,其有关制备途径及性质如下图所示。下列说法正确的是( )

A. 相对于途径②,途径①更好地体现了绿色化学思想
B. Y可以是葡萄糖溶液
C. X可能是SO2和SO3的混合气体
D. 将CuSO4溶液蒸发,利用余热蒸干,可制得胆矾晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,![]() 和
和![]() 的电离常数分别为
的电离常数分别为![]() 和
和![]() 。将
。将![]() 和体积均相同的两种酸溶液分别稀释,其
和体积均相同的两种酸溶液分别稀释,其![]() 随加水体积的变化如图所示。下列叙述正确的是( )
随加水体积的变化如图所示。下列叙述正确的是( )

A. 曲线Ⅰ代表![]() 溶液
溶液
B. 溶液中水的电离程度:b点>c点
C. 从c点到d点,溶液中 保持不变(其中
保持不变(其中![]() 、
、![]() 分别代表相应的酸和酸根离子)
分别代表相应的酸和酸根离子)
D. 相同体积a点的两溶液分别与![]() 恰好中和后,溶液中
恰好中和后,溶液中![]() 相同
相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,下列各组离子在指定溶液中一定能大量共存的是
A.![]() =1×10-12的溶液:K+、Na+、[Al(OH)4]-、CO32-
=1×10-12的溶液:K+、Na+、[Al(OH)4]-、CO32-
B.能溶解Al2O3的溶液:Na+、K+、HCO3-、NO3-
C.饱和氯水中:Cl-、NO3-、Na+、SO32-
D.能使甲基橙显红色的溶液:K+、Fe2+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g) ΔH=Q kJ·mol-1,其平衡常数随温度变化如表所示:
温度/k | 323 | 343 | 400 |
平衡常数 | 0.01 | 0.02 | 1 |
在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。
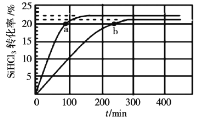
请回答下列问题:
(1)该反应的Q___0(填“>”或“<”)。
(2)代表323K曲线的是___(填a或b)
(3)在400K下,要缩短反应达到平衡的时间,可采取的措施有___、___。
(4)已知2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g)的反应速率v=v正-v逆,其中v正=k正x2SiHCl3,v逆=k逆xSiH2Cl2xSiCl4,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处![]() =___。
=___。
(5)TK时在体积为10L的反应器中,通入一定量的SiH2Cl2(g)和SiCl4(g),发生上述反应,SiH2Cl2(g)和SiCl4(g)浓度变化如图所示,则0~4 min时平均反应速率v(SiCl4(g))=___。
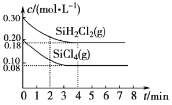
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com