解答:
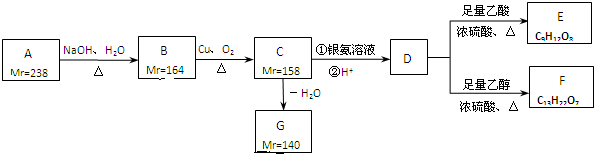
解:(1)图2中仪器X为球形冷凝管,起到冷凝作用,故答案为:球形冷凝管;
(2)氯化钙与双氧水的反应方程式为:CaCl
2+H
2O
2?CaO
2+2HCl,加入氨水可以与氯化氢发生中和反应,使该可逆反应向着生成过氧化钙的方向移动,提高的过氧化钙的产率,
故答案为:中和反应生成的HCl,使CaCl
2+H
2O
2?CaO
2+2HCl向右进行;
(3)由于温度较高时双氧水容易分解,会导致过氧化钙产率下降,且温度降低时过氧化钙的溶解度减小,有利于过氧化钙的析出,所以沉淀反应时常用冰水浴控制温度在0℃左右,
故答案为:减少双氧水受热分解;降低产物溶解度便于析出(或该反应放热);
(4)A.热水:过氧化钙在热水中溶解度较大,降低了过氧化钙的产率,故A错误;
B.冷水:过氧化钙极微溶于水,且杂质都易溶于水,可用冷水洗涤过氧化钙,故B正确;
C.乙醇:过氧化钙不溶于乙醇,但是杂质不溶于乙醇,且提高了成本,故C错误;
D.乙醚:过氧化钙不溶于乙醚,但杂质也不溶于乙醚,且乙醚成本较高,故D错误;
故答案为:B;
(5)过氧化钙具有强氧化性、能够与水反应,所以贮存过氧化钙时应该密封保存,且不能与易燃物接触,否则容易发生爆炸,
故答案为:密封(或防潮、避免与易燃物接触等);
(6)根据表中消耗高锰酸钾溶液的体积数据可知,第三次数据与其它三组误差较大,应该舍弃;则滴定中消耗酸性高锰酸钾的平均体积为:
mL=20.00mL,每次滴定消耗的高锰酸钾的物质的量为:n(KMnO
4)=0.1000mol/L×0.02L=0.002mol,
KMnO
4反应后生成Mn
2+,化合价降低7-2)=5价,CaO
2被氧化成氧气,化合价从-1升高到0价,至少升高:[0-(-1)]×2=2,根据化合价升降相等可得反应的关系式:2KMnO
4~5CaO
2,则每次称取0.4000g样品中含有的过氧化钙的物质的量为:n(CaO
2)=
×n(KMnO
4)=0.002mol×
=0.005mol,
所以该样品中过氧化钙的纯度为:
×100%=90.00%,
故答案为:90.00%;
(7)A.烘烤时间不足,样品中含有杂质水分,导致样品中过氧化钙的纯度偏小,故A正确;
B.在洁净干燥的酸式滴定管中未润洗即装标准液,标准液被蒸馏水稀释,滴定时消耗的标准液体积偏大,计算出的过氧化钙的纯度偏大,故B错误;
C.滴定前尖嘴处有气泡,滴定后消失,导致消耗的标准液体积偏大,根据关系式计算出的过氧化钙的质量偏大,过氧化钙的纯度偏高,故C错误;
D.配制KMnO
4标准溶液定容时俯视容量瓶标线,导致标准液浓度偏高,滴定过程中营养样品中过氧化钙的物质的量不变,则消耗的标准液体积偏小,测定的过氧化钙的纯度偏小,故D正确;
故答案为:AD.



 阅读快车系列答案
阅读快车系列答案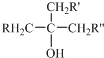 中的-OH不能被氧化.
中的-OH不能被氧化.