
工业上粗硅的生产原理为2C+SiO2 Si+2CO↑,下列说法正确的是
Si+2CO↑,下列说法正确的是
| A.SiO2是氧化剂 | B.SiO2发生氧化反应 |
| C.C表现出氧化性 | D.C被还原 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:单选题
Na2FeO4是一种高效多功能水处理剂,既能消毒杀菌,又能除去悬浮物杂质。一种制备Na2FeO4的反应原理为2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,下列有关说法正确的是 ( )
| A.反应中氧化剂是Na2O2,还原剂是FeSO4 |
| B.生成2 mol Na2FeO4时,反应中共有8 mol电子转移 |
| C.Na2FeO4的氧化性大于Na2O2 |
| D.Na2FeO4净水过程中,既有氧化还原反应发生,又有非氧化还原反应发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
根据表中信息,判断下列叙述中正确的是
| 序号 | 氧化剂 | 还原剂 | 其它反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | / | | Cl- |
| ② | KClO3 | 浓盐酸 | / | Cl2 | |
| ③ | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述正确的是
| A.非金属元素形成的离子一定是阴离子 |
| B.非金属单质在氧化还原反应中一定是氧化剂 |
| C.某元素从化合态变为游离态时,一定被还原 |
| D.金属阳离子被还原不一定得到金属单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
铬是人体必需的微量元素,但铬过量会引起污染,危害人体健康。不同
价态的铬毒性不一样,六价铬的毒性最大。下列叙述错误的是( )
| A.K2Cr2O7可以氧化乙醇,可用来鉴别司机是否酒后驾驶 |
| B.污水中铬一般以Cr3+存在,与水中的溶解氧作用可被还原为六价铬 |
| C.人体内六价铬超标,服用维生素C缓解毒性,说明维生素C具有还原性 |
| D.1 mol Cr2O72—得到6 mol电子时,还原产物是Cr3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
稀土金属铈(Ce)在空气中易氧化变暗,受热时燃烧,遇水很快反应。
已知:①铈常见的化合价为+3和+4;②氧化性:Ce4+>Fe3+。下列说法正确的是( )
A.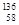 Ce、 Ce、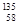 Ce、 Ce、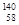 Ce、 Ce、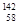 Ce它们互称为同素异形体 Ce它们互称为同素异形体 |
| B.工业上可以采用电解氯化铈水溶液来获得铈单质 |
| C.铈溶于氢碘酸的主要化学方程式可表示为2Ce+6HI=2CeI3+3H2↑ |
| D.工业上金属铈一般保存在敞口容器中 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述正确的是( )
| A.在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原 |
| B.元素由化合态变成游离态时,它可能被氧化,也可能被还原 |
| C.元素的原子得失电子后,一定形成8电子的稳定结构 |
| D.有单质参加或生成的反应一定属于氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某溶液中含有的溶质是FeBr2、FeI2,若先向该溶液中通入一定量的氯气,再向反应后的溶液中滴加KSCN溶液,溶液变为红色,则下列叙述正确的是( )
①原溶液中的Br-一定被氧化;②通入氯气之后原溶液中的Fe2+一定有部分或全部被氧化;③不能确定通入氯气后的溶液中是否存在Fe2+;④若取少量所得溶液,再加入CCl4,静置、分液,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中的I-、Fe2+、Br-均被完全氧化。
| A.①②③ | B.②③④ | C.①③④ | D.①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
检验海带中碘元素的实验中,发生如下反应:2H++2I-+H2O2=I2+2H2O,下列对该反应的叙述中不正确的是( )。
| A.I2为氧化产物 |
| B.H2O2既作氧化剂又作还原剂 |
| C.氧化性强弱顺序为H2O2>I2 |
| D.生成1 mol I2时转移2 mol电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com