
【题目】以CO和H2为原料生产二甲醚(CH3OCH3)主要发生以下三个反应

(1)该工艺的总反应为3CO(g)+3H2(g) ![]() CH3OCH3(g)+CO2(g)△H
CH3OCH3(g)+CO2(g)△H
该反应△H=_______________,化学平衡常数K=__________(用含K1、K2、K3的代数式表示)。
(2)某温度下,将8.0molH2和4 molCO充入容积为2L的密闭容器中,发生反应:4H2(g)+2CO(g) ![]() CH3OCH3(g)+H2O(g),5分钟后反应达平衡,测得二甲醚的体积分数为1/6,则用CH3OCH3的浓度变化表示该反应的速率为__________mol·L—1min—1,CO的转化率为_________。
CH3OCH3(g)+H2O(g),5分钟后反应达平衡,测得二甲醚的体积分数为1/6,则用CH3OCH3的浓度变化表示该反应的速率为__________mol·L—1min—1,CO的转化率为_________。
(3)下列措施中,既能加快反应速率又能提高CH3OCH3产率的有___________。
A.分离出二甲醚 B.升高温度 C.改用高效催化剂 D.增大压强
(4)该工艺中反应③的发生提高了CH3OCH3的产率原因是_________________________。
【答案】 -263 kJmol-1 K12·K2·K3 0.12mol·L1·min1 60% D 反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动,从而提高CH3OCH3的产率
【解析】(1)由盖斯定律可得,总反应3CO(g)+3H2(g) ![]() CH3OCH3(g)+CO2(g)为方程式①×2+②+③相加所得,故△H=2△H1+△H2+△H3=2×(-99)-24-41=-263 kJ·mol-1;总反应的平衡常数等于分反应的平衡常数之积,则K=K12·K2·K3 .
CH3OCH3(g)+CO2(g)为方程式①×2+②+③相加所得,故△H=2△H1+△H2+△H3=2×(-99)-24-41=-263 kJ·mol-1;总反应的平衡常数等于分反应的平衡常数之积,则K=K12·K2·K3 .
(2)可用体积分数求出各物质的浓度,然后再利用平衡常数的公式求出平衡常数,相同条件下,气体的体积分数等于其物质的量分数,设参加反应的n(CO)=xmol,
该反应中 4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g),
CH3OCH3(g)+H2O(g),
开始(mol) 8.0 4.0 0 0
反应(mol) 2x x 0.5x 0.5x
平衡(mol)8.0-2x 4.0-x 0.5x 0.5x
二甲醚物质的量分数=![]() ×100%=1/6,解得:x=2.4;用CH3OCH3的浓度变化表示该反应的速率为
×100%=1/6,解得:x=2.4;用CH3OCH3的浓度变化表示该反应的速率为![]() =0.12mol·L1·min1 ;则CO的转化率为2.4mol/4mol×100%=60%;(3)A、分离出二甲醚,降低生成物浓度,减慢反应速率,故A错误;B、升高温度,加快反应速率,平衡逆向移动,产率降低,故B错误;C、改用高效催化剂,加快反应速率,但平衡不移动,故C错误;D、增大压强,加快反应速率,平衡正向移动,能加快反应速率又能提高CH3OCH3产率,D正确;故选D。(4)该工艺中反应③的发生提高了CH3OCH3的产率原因是反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动,从而提高CH3OCH3的产率。
=0.12mol·L1·min1 ;则CO的转化率为2.4mol/4mol×100%=60%;(3)A、分离出二甲醚,降低生成物浓度,减慢反应速率,故A错误;B、升高温度,加快反应速率,平衡逆向移动,产率降低,故B错误;C、改用高效催化剂,加快反应速率,但平衡不移动,故C错误;D、增大压强,加快反应速率,平衡正向移动,能加快反应速率又能提高CH3OCH3产率,D正确;故选D。(4)该工艺中反应③的发生提高了CH3OCH3的产率原因是反应③消耗了反应②中的产物H2O,使反应②的化学平衡向正反应方向移动,从而提高CH3OCH3的产率。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R、M、N是7种短周期元素,原子序数依次增大。已知X组成的单质是密度最小的气体,Y是形成化合物种类最多的元素,W原子最外层电子数是次外层电子数的3倍,R、M、N处于同一周期,R是该周期中金属性最强的元素,R与N能形成化合物RN,M与W同一主族。
请回答下列问题:
(1)Z在周期表中的位置是________________;N的原子结构示意图是____________。
(2)X、Y形成含碳量最小的有机物分子的空间构型是_____________。
(3)X、W、N按照原子个数比1∶1∶1形成的化合物的电子式为_____________。
(4)W与R形成的化合物R2W2可作供氧剂,该化合物含有的化学键类型有: _________,该化合物与YW2反应的化学方程式是__________________________________________________________。
(5)在一定条件下,往M的氢化物的水溶液中通入N的单质,出现混浊,则该反应的化学方程式是_________。此反应可证明单质氧化性M___________N(填“>”、“<”或“=”)。
(6)以上几种元素任意组合,可形成的酸性最强的物质是________________________,可形成的碱性最强的物质是_______________________(填写化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d是四种短周期元素,a、b、d同周期,c、d同主族,a的原子结构示意图为:![]() ,b与c形成的化合物的化学式为b3c,且b、c离子有相同的电子层结构。下列比较中,正确的是( )
,b与c形成的化合物的化学式为b3c,且b、c离子有相同的电子层结构。下列比较中,正确的是( )
A. 原子序数:a>b>c B. 元素的非金属性:d>a>c
C. 原子半径:c>a>d D. 最高价含氧酸的酸性:d>c>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答问题:
(1)以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池中:
①H+向___________极移动(填“正”或“负”)。
②电子流动方向由____________极流向____________极(填:“正”、“负”)。
③若有1mol e- 流过导线,则理论上负极质量减少____________g。
④若将稀硫酸换成硫酸铜溶液,电极质量增加的是___________(填“锌极”或“铜极”),原因是_____________(用电极方程式表示)。
(2)一定温度下,在容积为2 L的密闭容器中进行反应:aN(g) ![]() bM(g) +cP(g),M、N、P的物质的量随时间变化的曲线如图所示:
bM(g) +cP(g),M、N、P的物质的量随时间变化的曲线如图所示:

①反应化学方程式中各物质的系数比为a∶b∶c=_________。
②1 min到3 min这段时刻,以M的浓度变化表示的平均反应速率为:________________________。
③下列叙述中能说明上述反应达到平衡状态的是____________________________。
A.反应中当M与N的物质的量相等时
B.P的质量不随时间变化而变化
C.混合气体的总物质的量不随时间变化而变化
D.单位时间内每消耗a mol N,同时消耗b mol M
E.混合气体的压强不随时间的变化而变化
F.M的物质的量浓度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主族元素在周期表中的位置,取决于该元素的( )
A.最外层电子数和相对原子质量
B.相对原子质量和核外电子数
C.次外层电子数和电子层数
D.电子层数和最外层电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于甲烷的叙述正确的是( )
A.甲烷分子的立体构型是正四面体,所以CH2Cl2有两种不同构型
B.甲烷可以与氯气在加热的条件下发生取代反应
C.甲烷能够燃烧,在一定条件下会发生爆炸,因此,是矿井安全的重要威胁之一
D.甲烷能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】气体是物质聚集状态的重要形式之一,在实验室或工业上经常需制备气体。以下是某同学设计的实验室制备氨气的一些装置。
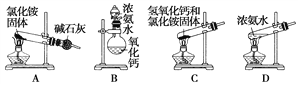
(1)上面是实验室制取氨气的装置和选用的试剂,其中不能得到氨气的是________(填字母)。
(2)利用装置B和下列提供的试剂,能制备的下列气体有________________(填气体的化学式)。
气体 | 所用试剂 |
SO2 | NaHSO3(固)+H2SO4(浓) |
Cl2 | MnO2(固)+HCl(浓) |
H2S | Na2S(固)+H2SO4(浓) |
O2 | Na2O2 (固)+H2O |
(3)实验室制备、收集干燥的NO2,所需仪器如图所示,按气流方向连接各仪器接口,顺序为a→________→________→________→________→f。装置D的作用是__________________________,装置E中盛放的溶液是________。制备时,烧瓶中装少量铜片,从分液漏斗向烧瓶中滴加浓硝酸,烧瓶中的现象是__________________________________________________________________。
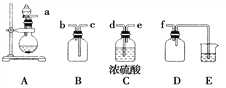
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液X中只可能溶有K+、Mg2+、Al3+、AlO![]() 、SiO
、SiO![]() 、SO
、SO![]() 、CO
、CO![]() 、SO
、SO![]() 中的若干种离子。某同学对该溶液进行了如下实验。则下列判断正确的是
中的若干种离子。某同学对该溶液进行了如下实验。则下列判断正确的是

A. 气体甲一定是纯净物
B. 沉淀甲是硅酸和硅酸镁的混合物
C. K+、AlO![]() 和SiO
和SiO![]() 一定存在于溶液X中
一定存在于溶液X中
D. CO![]() 和SO
和SO![]() 一定不存在于溶液X中
一定不存在于溶液X中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)画出下列元素的原子结构示意图。
①核电荷数为13的元素:__________。
②某元素原子的最外层电子数等于次外层电子数:__________________ 。
③L 层电子数是M层电子数2倍的元素: ___________________ 。
④某同位素原子核内没有中子的元素: ___________________ 。
(2)写出1~18号元素中符合下列条件的原子(离子)的微粒符号和结构示意图。
①某元素原子L层上的电子数为K层的3倍: __________________ 。
②某元素原子L层上的电子数为K层的一半: _________________ 。
③得到2个电子后,电子总数与氩原子的电子总数相同的离子: ___________________ 。
④某元素原子的最外层电子数等于次外层电子数的2倍: ___________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com