
【题目】a、b、c、d是四种短周期元素,a、b、d同周期,c、d同主族,a的原子结构示意图为:![]() ,b与c形成的化合物的化学式为b3c,且b、c离子有相同的电子层结构。下列比较中,正确的是( )
,b与c形成的化合物的化学式为b3c,且b、c离子有相同的电子层结构。下列比较中,正确的是( )
A. 原子序数:a>b>c B. 元素的非金属性:d>a>c
C. 原子半径:c>a>d D. 最高价含氧酸的酸性:d>c>a
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】有0.1 mol/L的盐酸(a)、硫酸溶液(b)、醋酸溶液(c)各50 mL,试比较:
(1)三种酸的氢离子浓度由大到小的顺序是_________;三种酸的pH由大到小的顺序是______(填字母代号,下同)。
(2)三种酸跟足量的锌反应,开始时产生H2的速率由大到小的顺序是____________(不考虑Zn的纯度及表面积等问题)。
(3)三种酸跟足量的锌反应产生H2的体积由大到小的顺序是__________________。
(4)三种酸分别跟0.1 mol/L的NaOH溶液中和,消耗NaOH溶液的体积由大到小的顺序是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2(其中氧元素为-2价)是一种消毒杀菌效率高、二次污染小的水处理剂。实验室中可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O。
2ClO2↑+K2SO4+2CO2↑+2H2O。
(1)该反应中氧化剂是__________。
(2)当收集到标况下气体22.4L时,求参加反应的H2C2O4质量和物质的量__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学―选修5:有机化学基础】
聚碳酸酯(PC)是一种强韧的热塑性树脂,广泛用于玻璃装配业、汽车工业、电子和电器工业。PC的一种合成路径如下:
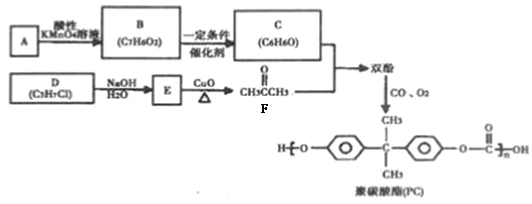
回答下列问题:
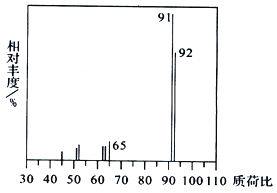
(1)烃A 的质谱图如下,则A 的分子式为__________。
(2)D 的名称为_________,D→E的反应类型为_______。
(3)双酚的结构简式为_______。
(4)B 和E 可以形成一种酯类物质F,写出B + E→F反应的化学方程式:_______。
(5)F的同分异构体中,能同时满足如下条件的共有______种(不考虑立体异构)。
① 分子中有两个甲基;
② 能发生银镜反应;
③ 在酸性溶液中的水解产物遇FeC13 溶液显紫色。
写出其中核磁共振氢谱显示5组峰,且峰面积比为62:2:11的种分子的结构简式:_______。
(6)写出由D分子合成甘油(丙三醇)的合成路线图_______。(已知:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使用SNCR脱硝技术的原理是4NO(g)+4NH3(g)![]() 4N2(g)+6H2O(g),下图是其在密闭体系中研究反应条件对烟气脱硝效率的实验结果。下列说法正确的是( )
4N2(g)+6H2O(g),下图是其在密闭体系中研究反应条件对烟气脱硝效率的实验结果。下列说法正确的是( )
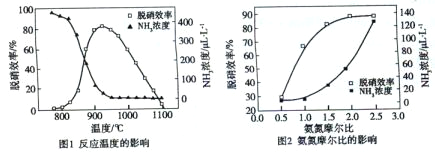
A. 从图1判断,该反应的正反应方向是放热反应
B. 从图2判断,减少氨气的浓度有助于提高NO的转化率
C. 从图1判断,脱硝的最佳温度约为 925℃
D. 从图2判断,综合考虑脱硝效率和运行成本最佳氨氮摩尔比应为2.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机化学反应属于加成反应的是
A.甲烷和氯气混合光照颜色逐渐变浅B.乙烯通入溴的四氯化碳溶液使其褪色
C.苯和液溴混合物中加入铁屑D.乙醇和金属钠反应产生氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙酸乙酯(C4H8O2)是一种无色液体,不溶于水,密度小于1 g·mL-1,沸点约为55 ℃。要从水与乙酸乙酯的混合物中将乙酸乙酯分离出来,下列方法中最简便的是
A.蒸馏B.分液C.过滤D.蒸发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以CO和H2为原料生产二甲醚(CH3OCH3)主要发生以下三个反应

(1)该工艺的总反应为3CO(g)+3H2(g) ![]() CH3OCH3(g)+CO2(g)△H
CH3OCH3(g)+CO2(g)△H
该反应△H=_______________,化学平衡常数K=__________(用含K1、K2、K3的代数式表示)。
(2)某温度下,将8.0molH2和4 molCO充入容积为2L的密闭容器中,发生反应:4H2(g)+2CO(g) ![]() CH3OCH3(g)+H2O(g),5分钟后反应达平衡,测得二甲醚的体积分数为1/6,则用CH3OCH3的浓度变化表示该反应的速率为__________mol·L—1min—1,CO的转化率为_________。
CH3OCH3(g)+H2O(g),5分钟后反应达平衡,测得二甲醚的体积分数为1/6,则用CH3OCH3的浓度变化表示该反应的速率为__________mol·L—1min—1,CO的转化率为_________。
(3)下列措施中,既能加快反应速率又能提高CH3OCH3产率的有___________。
A.分离出二甲醚 B.升高温度 C.改用高效催化剂 D.增大压强
(4)该工艺中反应③的发生提高了CH3OCH3的产率原因是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应原理对生产有重大的指导意义。回答下列问题:
(1)有两个温度相同的密闭容器A和B,容器A保持容积不变,容器B保持压强不变,起始时向容积相等的A、B中分别充入等量的C(碳)和H2O(g),发生反应:C(s)+H2O(g)![]() CO(g)+ H2(g) (正反应为吸热反应),并分别达到平衡。
CO(g)+ H2(g) (正反应为吸热反应),并分别达到平衡。
①H2O的体积分数:V(A)%_____V(B)%。(填“>”、“<” “=”)
②达到平衡后,在两容器中分别通入等量的氦气,则A中H2O的转化率_______(填“增大” “减小”、“不变”);B中化学平衡_________移动(填“不”“向正反应方向”“向逆反应方向”)。
(2)某温度下,测得0.01mol·L-1 NaOH溶液的pH=10,则在该温度下Kw=______;在此温度下,将pH=11的NaOH溶液aL与pH=2的H2SO4溶液bL混合,若所得溶液为中性,则a:b=_______(假设混合时体积不变)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com