
【题目】下列有机化学反应属于加成反应的是
A.甲烷和氯气混合光照颜色逐渐变浅B.乙烯通入溴的四氯化碳溶液使其褪色
C.苯和液溴混合物中加入铁屑D.乙醇和金属钠反应产生氢气
科目:高中化学 来源: 题型:
【题目】在下列各变化中,反应①为常温下的反应,A、C、D均含氯元素,且A中氯元素的化合价介于C与D之间,E常温下为无色无味的液体,F为淡黄色粉末,G为常见的无色气体。
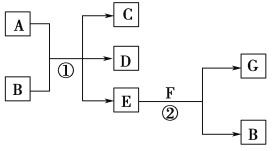
回答下列问题:
(1)A、G的化学式分别为________、________。
(2)写出反应②的化学方程式:___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】基于CaSO4为载氧体的天然气燃烧是一种新型绿色的燃烧方式,CaSO4作为氧和热量的有效载体,能够髙效低能耗地实现CO2的分离和捕获其原理如下图所示:
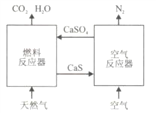
(1)已知在燃料反应器中发生如下反应:
i.CaSO4(g)+CH4(g)=4CaO(s)+CO2(g)+4SO2(g)+2H2O(g) ΔH1=akJ/mol
ii.CaSO4(s)+CH4(g)=CaS(s)+CO2(g)+2H2O(g) ΔH2=bkJ/mol
ⅲ. CaS(s)+3CaSO4(s)= 4CaO(s)+4SO2(g) ΔH3=ckJ/mol
①燃料反应器中主反应为_____________(填“i”“ ii”或“ⅲ”)。
②反应i和ii的平衡常数Kp与温度的关系如图1,则a_____________ 0(填“>”“ =” 或“<”);720℃时反应ⅲ的平衡常数Kp=_________________。
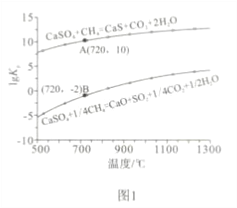

③下列措施可提高反应ii中甲烷平衡转化率的是______________ 。
A.增加CaSO4固体的投入量 B.将水蒸气冷凝
C.降温 D.增大甲烷流量
(2)如图2所示,该燃料反应器最佳温度范围为850℃-900℃之间,从化学反应原理的角度说明原因:
________________________。
(3)空气反应器中发生的反应为
CaS(s) +2O2(g)=CaSO4(s) ΔH4=dkJ/mol
①根据热化学原理推测该反应为 __________________(填“吸热”或“放热”) 反应。
(4)该原理总反应的热化学方程式为_____________________________。
(5)25℃时,用Na2S沉淀Cu2+、Sn2+两种金属离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如右图所示,请回答:

25℃时向50mL的Sn2+、Cu2+浓度均为0.01 mol/L的混合溶液中逐滴加入Na2S溶液,当Na2S溶液加到150mL时开始生成SnS沉淀,则此时溶液中Cu2+浓度为___________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是
A. 用KIO3氧化酸性溶液中的KI:5I—+IO3—+3H2O==I2+6OH—
B. 向NH4HCO3溶液中加过量Ba(OH)2溶液并加热:NH4++OH—![]() NH3↑+H2O
NH3↑+H2O
C. 在海带灰的浸出液(含有I—)中滴加H2O2得到I2:2I—+H2O2+2H+==I2+2H2O
D. 用浓硝酸洗涤试管内壁的银镜Ag+2H++NO3—==Ag++NO↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d是四种短周期元素,a、b、d同周期,c、d同主族,a的原子结构示意图为:![]() ,b与c形成的化合物的化学式为b3c,且b、c离子有相同的电子层结构。下列比较中,正确的是( )
,b与c形成的化合物的化学式为b3c,且b、c离子有相同的电子层结构。下列比较中,正确的是( )
A. 原子序数:a>b>c B. 元素的非金属性:d>a>c
C. 原子半径:c>a>d D. 最高价含氧酸的酸性:d>c>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列情况中,能通过置换反应得到铁的是( )
A.铜与氯化亚铁溶液常温下混合
B.一氧化碳通过灼热的三氧化二铁
C.氢气通入硫酸亚铁溶液
D.铝和四氧化三铁混合加热到高温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答问题:
(1)以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池中:
①H+向___________极移动(填“正”或“负”)。
②电子流动方向由____________极流向____________极(填:“正”、“负”)。
③若有1mol e- 流过导线,则理论上负极质量减少____________g。
④若将稀硫酸换成硫酸铜溶液,电极质量增加的是___________(填“锌极”或“铜极”),原因是_____________(用电极方程式表示)。
(2)一定温度下,在容积为2 L的密闭容器中进行反应:aN(g) ![]() bM(g) +cP(g),M、N、P的物质的量随时间变化的曲线如图所示:
bM(g) +cP(g),M、N、P的物质的量随时间变化的曲线如图所示:

①反应化学方程式中各物质的系数比为a∶b∶c=_________。
②1 min到3 min这段时刻,以M的浓度变化表示的平均反应速率为:________________________。
③下列叙述中能说明上述反应达到平衡状态的是____________________________。
A.反应中当M与N的物质的量相等时
B.P的质量不随时间变化而变化
C.混合气体的总物质的量不随时间变化而变化
D.单位时间内每消耗a mol N,同时消耗b mol M
E.混合气体的压强不随时间的变化而变化
F.M的物质的量浓度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于甲烷的叙述正确的是( )
A.甲烷分子的立体构型是正四面体,所以CH2Cl2有两种不同构型
B.甲烷可以与氯气在加热的条件下发生取代反应
C.甲烷能够燃烧,在一定条件下会发生爆炸,因此,是矿井安全的重要威胁之一
D.甲烷能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)相邻的两个或多个原子之间 ,叫作化学键。通常,主族元素中活泼的 和活泼的 相互化合时分别失去和得到电子,形成具有稀有气体元素原子结构的 离子和 离子。这些离子之间除了有相互吸引的作用外,还有 和 、 和 之间的相互排斥作用。当两种离子之间接近到一定距离时, 和 作用达到了平衡,于是就形成了稳定的化学键。这种由 间通过 所形成的化学键叫作离子键。
(2)写出下列物质的电子式:
①氟化钙 ;
②溴化钾 ;
③硫化钠 ;
④氧化钙 。
(3)用电子式表示下列离子化合物的形成过程:
①氧化钠 。
②氯化镁 。
③硫化钠 。
④氯化铷 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com