
【题目】基于CaSO4为载氧体的天然气燃烧是一种新型绿色的燃烧方式,CaSO4作为氧和热量的有效载体,能够髙效低能耗地实现CO2的分离和捕获其原理如下图所示:
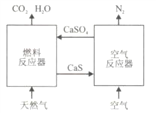
(1)已知在燃料反应器中发生如下反应:
i.CaSO4(g)+CH4(g)=4CaO(s)+CO2(g)+4SO2(g)+2H2O(g) ΔH1=akJ/mol
ii.CaSO4(s)+CH4(g)=CaS(s)+CO2(g)+2H2O(g) ΔH2=bkJ/mol
ⅲ. CaS(s)+3CaSO4(s)= 4CaO(s)+4SO2(g) ΔH3=ckJ/mol
①燃料反应器中主反应为_____________(填“i”“ ii”或“ⅲ”)。
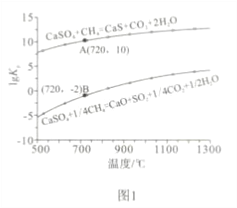
②反应i和ii的平衡常数Kp与温度的关系如图1,则a_____________ 0(填“>”“ =” 或“<”);720℃时反应ⅲ的平衡常数Kp=_________________。

③下列措施可提高反应ii中甲烷平衡转化率的是______________ 。
A.增加CaSO4固体的投入量 B.将水蒸气冷凝
C.降温 D.增大甲烷流量
(2)如图2所示,该燃料反应器最佳温度范围为850℃-900℃之间,从化学反应原理的角度说明原因:
________________________。
(3)空气反应器中发生的反应为
CaS(s) +2O2(g)=CaSO4(s) ΔH4=dkJ/mol
①根据热化学原理推测该反应为 __________________(填“吸热”或“放热”) 反应。
(4)该原理总反应的热化学方程式为_____________________________。
(5)25℃时,用Na2S沉淀Cu2+、Sn2+两种金属离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如右图所示,请回答:

25℃时向50mL的Sn2+、Cu2+浓度均为0.01 mol/L的混合溶液中逐滴加入Na2S溶液,当Na2S溶液加到150mL时开始生成SnS沉淀,则此时溶液中Cu2+浓度为___________mol/L。
【答案】 ii > 1.0×10-18 B 温度过低,反应速率较慢;温度较高,副反应增多 放热 CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=(b+d)kJ/mol或ΔH=(a-c+d)kI/mol 2.5×10-13
【解析】(1)①:反应ii中生成的CaS在反应ⅲ中继续反应,有利于反应ii的正向进行,反应的程度大,故ii反应是主要反应;②:反应i的lgK随着温度的升高增大,所以K也增大,平衡正向移动,所以正反应是吸热反应,a>0;反应ⅲ= 反应i-反应ii,所以反应ⅲ的平衡常数Kp=Kpi/ Kp ii=(10-2)4÷1010=10-18;③:A、增加CaSO4固体的投入量对平衡无影响; B、将水蒸气冷凝,生成物的浓度减小,平衡正向移动,CH4的转化率增大;C、反应 ii的平衡常数随温度降低而降低,即降温平衡逆向移动,CH4的转化率减小;D、增大甲烷流量,平衡正向移动,但CH4的转化率反而减小。故可提高反应ii中甲烷平衡转化率的是B。
(2)温度较低时,CaS的摩尔分数虽然较大,但反应速率太慢,温度太高时,副产物CaO的含量较大,即副反应增多,故答案为:温度过低,反应速率较慢;温度较高,副反应增多。
(3) ①CaS(s) +2O2(g)=CaSO4(s)是一个熵减的自发反应,ΔS<0,根据吉布斯自由能ΔG=ΔH-TΔS<0,可知ΔH<0,所以该反应正反应一定是放热反应。
(4) 对于CaSO4(s)+CH4(g)=CaS(s)+CO2(g)+2H2O(g)ΔH2=bkJ/mol和CaS(s)+2O2(g)=CaSO4(s) ΔH4=dkJ/mol,两个热化学方程式相加可得甲烷燃烧的热化学方程式为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=(b+d)kJ/mol,因为反应ⅲ= 反应i-反应ii,所以焓变关系有c=a-b,故有b=a-c,故ΔH=(b+d)kJ/mol=(a-c+d)kI/mol,答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=(b+d)kJ/mol或ΔH=(a-c+d)kI/mol。
(5)两条曲线均是溶解平衡曲线,lgc(Sn2+)+lgc(S2-)=-25,所以Ksp(SnS)=10-25, lgc(Cu2+)+lgc(S2-)=-35,所以Ksp(CuS)=10-35。向50mL的Sn2+、Cu2+浓度均为0.01 mol/L的混合溶液中逐滴加入150mL Na2S溶液时,Sn2+的浓度为0.01/4(mol/L),此时Sn2+开始沉淀,则c(S2-)= Ksp(SnS)÷c(Sn2+)=10-25÷0.01/4(mol/L)=4×10-23 mol/L,所以c(Cu2+)= Ksp(CuS)÷c(S2-)=10-35÷(4×10-23 )mol/L=2.5×10-13。


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】生活中的有机物种类丰富,在衣食住行等多方面应用广泛,其中乙醇和乙酸是比较常见的有机物。
(1)工业上用乙烯与水反应可制得乙醇,该反应的化学方程式为_______________(不用写反应条件)。
(2)乙醇能够发生氧化反应:乙醇在铜作催化剂的条件下可被氧气氧化为乙醛,反应的化学方程式为_______。
(3)下列关于乙醇的说法正确的是______(选填字母)。
A.乙醇不能和酸性高锰酸钾溶液发生氧化还原反应
B.乙醇只能被氧化成乙醛
C.黄酒中某些微生物使乙醇氧化为乙酸,于是酒就变酸了
(4)当乙酸分子中的O都是18O时,乙醇分子中的O都是16O时,二者在一定条件下反应,生成物中水的相对分子质量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验室需要0.5 mol·L-1硫酸溶液450 mL。根据溶液的配制情况回答下列问题:

(1)如图所示的仪器中配制溶液肯定不需要的是______(填序号),配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。
(2)现用质量分数为98%、密度为1.84 g·cm-3的浓硫酸来配制450 mL、0.5 mol·L-1的稀硫酸。计算所需浓硫酸的体积为________ mL(保留1位小数),现有
①10 mL ②25 mL ③50 mL ④100 mL四种规格的量筒,你选用的量筒是________(填代号)。
(3)配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是__________________________________________________________。
(4)配制时,一般可分为以下几个步骤:
①量取 ②计算 ③稀释 ④摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为:②→①→③→________→ ________→________→________→④(填序号)。_________
(5)在配制过程中,其他操作都准确,下列操作中错误的是________(填代号,下同),能引起误差偏高的有________。
①洗涤量取浓硫酸后的量筒,并将洗涤液转移到容量瓶中
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③将浓硫酸直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓硫酸
④定容时,加蒸馏水超过刻度线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至刻度线
⑦定容时,俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有Fe3+、Fe2+、Cu2+的溶液中加入铁粉,充分反应后,固体残渣用盐酸处理有气体放出,则与铁粉反应后的溶液中最多的离子是( )
A.Fe3+
B.Fe2+
C.Cu2+
D.H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2(其中氧元素为-2价)是一种消毒杀菌效率高、二次污染小的水处理剂。实验室中可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O。
2ClO2↑+K2SO4+2CO2↑+2H2O。
(1)该反应中氧化剂是__________。
(2)当收集到标况下气体22.4L时,求参加反应的H2C2O4质量和物质的量__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用。如可利用NaOH溶液来“捕捉”CO2,其基本过程如图所示(部分条件及物质未标出)。
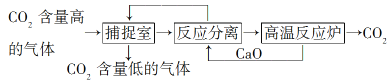
下列有关该方法的叙述中正确的是( )
①能耗小是该方法的一大优点
②整个过程中,有两种物质可以循环利用
③“反应分离”环节中,分离物质的基本操作是蒸发、结晶
④该方法可减少碳排放,“捕捉”到的CO2还可用来制备甲醇等产品
A. ①③ B. ②④ C. ③④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学―选修5:有机化学基础】
聚碳酸酯(PC)是一种强韧的热塑性树脂,广泛用于玻璃装配业、汽车工业、电子和电器工业。PC的一种合成路径如下:
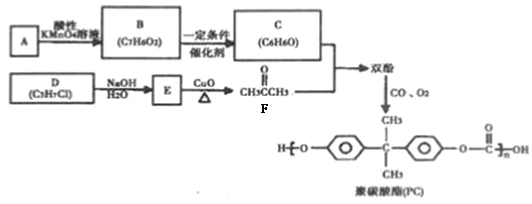
回答下列问题:
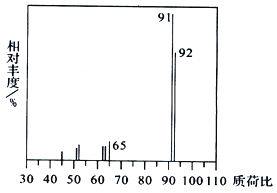
(1)烃A 的质谱图如下,则A 的分子式为__________。
(2)D 的名称为_________,D→E的反应类型为_______。
(3)双酚的结构简式为_______。
(4)B 和E 可以形成一种酯类物质F,写出B + E→F反应的化学方程式:_______。
(5)F的同分异构体中,能同时满足如下条件的共有______种(不考虑立体异构)。
① 分子中有两个甲基;
② 能发生银镜反应;
③ 在酸性溶液中的水解产物遇FeC13 溶液显紫色。
写出其中核磁共振氢谱显示5组峰,且峰面积比为62:2:11的种分子的结构简式:_______。
(6)写出由D分子合成甘油(丙三醇)的合成路线图_______。(已知:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机化学反应属于加成反应的是
A.甲烷和氯气混合光照颜色逐渐变浅B.乙烯通入溴的四氯化碳溶液使其褪色
C.苯和液溴混合物中加入铁屑D.乙醇和金属钠反应产生氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源“非石油化”是战略目标,发展以CH4、CO2等为原料的“C1化学”成为当今化工生产的必然趋势。通常天然气中含有H2S等有毒气体,下面为天然气合成氨的工艺流程。
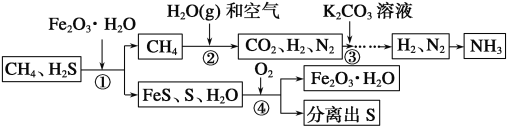
(1)合成氨的原料之一为氮气,该流程中为合成氨提供氮气的物质是__________。
(2)①处加入Fe2O3·H2O的目的是__________。
(3)②处CH4与H2O(g)反应生成CO2、H2,反应的化学方程式是_________________________。
(4)③处一般加入K2CO3溶液以吸收CO2,K2CO3溶液与CO2反应生成碳酸氢钾(KHCO3),该反应的化学方程式是________________________。
(5)该流程中参与循环的物质是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com