
【题目】I.下面是7×18的格子,按要求作答。

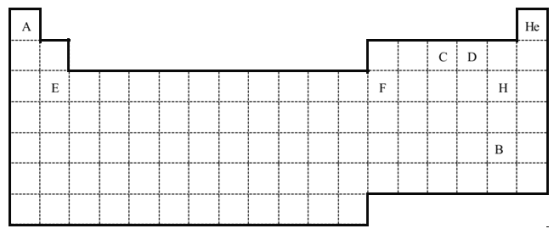
(1)用封闭的实线绘出元素周期表的轮廓。_______________
(2)“大爆炸理论”指出:200亿年以前,宇宙中所有物质都包含在一个密度无限大、温度无限高的原始核中,由于某种原因它发生了爆炸,首先产生了中子、质子和电子,随后就产生了元素,已知这种元素的一种核素没有中子。你由此可知最先产生的元素是________ (填写元素名称),该元素的另一种核素,其中子数比质子数多1,此种核素的原子符号是________。
(3)C、D、E、F的简单离子半径由小到大的顺序是____________(填写离子符号)。
(4)请用电子式表示出E和H组成的化合物的形成过程:_________________。
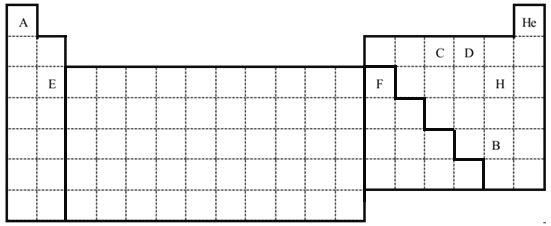
(5)用实线绘出金属与非金属的分界线;用实线绘出过渡元素的分界线。_____________
(6)请写出B形成的单质与氢气反应的化学方程式:______________。
(7)下列各种叙述中,正确的是__________。
a.化学键可分为离子键、共价键、极性键和非极性键四种类型
b.由非金属元素组成的化合物不一定是共价化合物
c.非极性键只存在于双原子单质分子里
d.在Na2S溶液中加入氯水,溶液中出现黄色沉淀,可以说明氯元素的非金属性比硫元素强
e.卤素氟、氯、溴、碘的氢化物的沸点由低到高的顺序为:HF<HCl<HBr<HI
f.构成单质分子的粒子不一定含有共价键
【答案】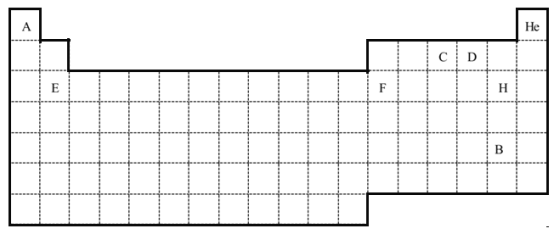 氢 13H Al3+<Mg2+<O2-<N3-
氢 13H Al3+<Mg2+<O2-<N3- ![]()
 I2+H2
I2+H2![]() 2HI bdf
2HI bdf
【解析】
(1)元素周期表有七个周期,18个纵行共16个族,根据元素周期表结构画出元素周期表的轮廓;
(2)不含中子的原子为氢原子,所以最先产生的元素是氢元素;氢元素中的另一种核素,其中子数比质子数多1,则质量数为1+2=3,该种核素的原子符号是13H;
(3)具有相同核外电子排布的离子,核电荷数越大,半径越小;
(4)Mg和Cl形成离子化合物MgCl2;
(5)元素周期表中在B、Si、As、Te、At和Al、Ge、Sb、Po之间的折线为金属与非金属的分界线;元素周期表中IIIB~IIB族的元素为过渡元素;
(6)碘与氢气在加热条件下反应生成HI,该反应为可逆反应,反应的化学方程式为:I2+H2![]() 2HI;
2HI;
(7)a.化学键可分为离子键、共价键,共价键分为极性键和非极性键;
b.由非金属元素组成的化合物不一定是共价化合物,如NH4Cl为离子化合物;
c.非极性键可能存在于共价化合物或离子化合物中,如H2O2和Na2O2中含有非极性键;
d.在Na2S溶液中加入氯水,溶液中出现黄色沉淀,发生置换反应,氯气作氧化剂,硫为氧化产物,可以说明氯元素的非金属性比硫元素强;
e.HF分子间形成氢键,沸点升高;
f.构成单质分子的粒子不一定含有共价键,如稀有气体为单原子分子,分子中不存在化学键。
(1)元素周期表有七个周期,18个纵行共16个族,用封闭的实线绘出元素周期表的轮廓为:
(2)不含中子的原子为氢原子,所以最先产生的元素是氢元素;氢元素中的另一种核素,其中子数比质子数多1,则质量数为1+2=3,该种核素的原子符号是13H,
故答案为:氢;13H;
(3)具有相同核外电子排布的离子,核电荷数越大,半径越小,N、O、Mg、Al的简单离子半径由小到大的顺序是Al3+<Mg2+<O2-<N3-,
故答案为:Al3+<Mg2+<O2-<N3-;
(4)Mg和Cl形成离子化合物MgCl2 ,用电子式表示形成过程为:![]() ,
,
故答案为:![]()
(5)元素周期表中在B、Si、As、Te、At和Al、Ge、Sb、Po之间的折线为金属与非金属的分界线;元素周期表中IIIB~IIB族的元素为过渡元素,用实线绘出过渡元素的分界线,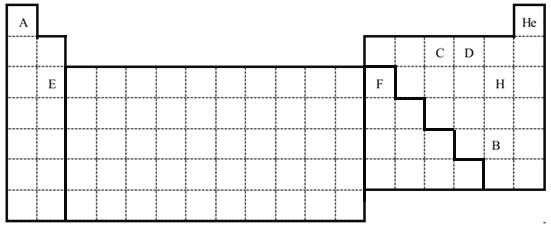 ;
;
(6)碘与氢气在加热条件下反应生成HI,该反应为可逆反应,反应的化学方程式为:I2+H2![]() 2HI,
2HI,
故答案为:I2+H2![]() 2HI;
2HI;
(7)a.化学键可分为离子键、共价键,共价键分为极性键和非极性键,故a错误;
b.由非金属元素组成的化合物不一定是共价化合物,如NH4Cl为离子化合物,故b正确;
c.非极性键可能存在于共价化合物或离子化合物中,如H2O2和Na2O2中含有非极性键,故c错误;
d.在Na2S溶液中加入氯水,溶液中出现黄色沉淀,发生置换反应,氯气作氧化剂,硫为氧化产物,可以说明氯元素的非金属性比硫元素强,故d正确;
e.HF分子间形成氢键,沸点升高,故e错误;
f.构成单质分子的粒子不一定含有共价键,如稀有气体为单原子分子,分子中不存在化学键,故f正确。
综合以上分析,bdf正确,
故答案为:bdf。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】已知某有机物A的红外光谱和核磁共振氢谱如下图所示,下列说法中错误的是
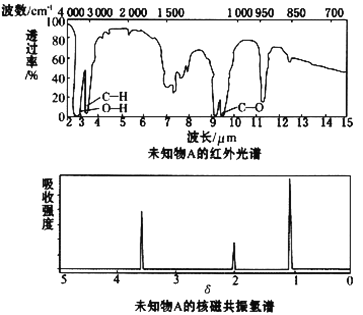
A. 由红外光谱可知,该有机物中至少含有三种不同的化学键
B. 由核磁共振氢谱可知,该有机物分子中有三种不同的氢原子且个数比为1:2:3
C. 仅由其核磁共振氢谱可知其分子中的氢原子总数
D. 若A的化学式为C2H6O,则其结构简式为CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各微粒半径依次增大的是( )
A. Ca2+、K+、Mg2+、Al3+
B. F-、Cl-、Br-、I-
C. Si、Al、Mg、Na
D. Ca2+、K+、Cl-、S2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列有关叙述正确的是( )
A. 14 g乙烯和丙烯混合气体中的氢原子数为2NA
B. 1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C. 1 mol Fe溶于过量硝酸,电子转移数为2NA
D. 标准状况下,2.24 L CCl4含有的共价键数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。有关物质的部分性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
SO2Cl2 | -54.1 | 69.1 | ①易水解,产生大量白雾 ②易分解:SO2Cl2 |
H2SO4 | 10.4 | 338 | 吸水性且不易分解 |
实验室用干燥而纯净的二氧化硫和氯气合成硫酰氯,装置如图所示(夹持仪器已省略),请回答有关问题:
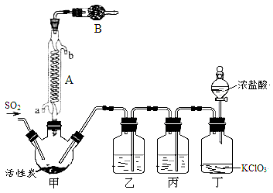
(1)仪器A冷却水的进口为 (填“a”或“b”)。
(2)仪器B中盛放的药品是 。
(3)实验时,装置丁中发生反应的离子方程式为 。
(4)装置丙的作用为 ,若缺少装置乙,则硫酰氯会水解,该反应的化学方程式为 。
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H=H2SO4 + SO2Cl2,此方法得到的产品中会混有硫酸。
①从分解产物中分离出硫酰氯的方法是 。
②请设计实验方案检验产品中有硫酸(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液): 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氯水的叙述,正确的是( )
A. 新制氯水中只含有Cl2和H2O分子
B. 新制氯水可使蓝色石蕊试纸先变红后褪色
C. 光照氯水有气泡逸出,该气体是Cl2
D. 氯水放置数天后,酸性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟利昂是饱和碳氢化台物的卤族衍生物的总称,其破坏臭氧层的化学反应机理如下(以F-12 (二氯二氟甲烷)为例):
CF2Cl2![]() CF2Cl+Cl Cl+O3→ClO+O2
CF2Cl+Cl Cl+O3→ClO+O2
ClO+ClO→ClOOCl(过氧化氯) ClOOCl![]() 2Cl+O2
2Cl+O2
下列说法中不正确的是
A. 紫外线可以增大CF2Cl2的分解速率 B. ClO +ClO![]() ClOOC1的反应中有非极性键的形成
ClOOC1的反应中有非极性键的形成
C. CF2Cl2是臭氧破坏反应的催化剂 D. 臭氧屡破坏的关键因素有:氟利昂,太阳光
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 因为NH3·H2O是弱碱,所以不能用氨水与FeCl3溶液反应制取Fe(OH)3
B. 向FeI2溶液中通入少量Cl2,再滴加少量CCl4,振荡、静置,下层液体为紫色
C. 向一定体积的热浓硫酸中加入足量的铁粉,生成的气体能被烧碱溶液完全吸收
D. 将SO2气体通入溴水,欲检验是否有SO42-生成,可向溶液中滴加Ba(NO3) 2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如下表所示:
元素代号 | X | Y | Z | M | Q | R |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.075 | 0.077 | 0.037 |
主要化合价 | +2 | +3 | +6,-2 | +5,-3 | +4,-4 | +1 |
(1)单质铜和元素M的最高价氧化物对应的水化物的稀溶液发生反应的离子方程式为________________________________________________________________________。
(2)元素Q、元素Z的含量影响钢铁性能,采用下图装置A在高温下将钢样中元素Q、元素Z转化为QO2、ZO2。
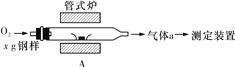
①气体a的成分是________________(填化学式)。
②若钢样中元素Z以FeZ的形式存在,在装置A中反应生成ZO2和稳定的黑色氧化物,则反应的化学方程式是:______________________________________________。
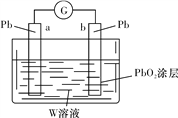
(3)用Z的最高价含氧酸W的溶液作电解质溶液(体积为1 L,假设反应前后溶液体积变化忽略不计)组装成原电池(如图所示)。则在a电极上发生的反应可表示为_________________。若电池工作一段时间后,a极消耗0.05 mol Pb,则W溶液的浓度由质量分数39%(密度为1.3 g/cm3)变为______mol/L(保留一位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com