
【题目】甲、乙、丙、丁4种物质分别含2种或3种元素,它们的分子中均含18个电子,甲是气态氢化物,在水中分步电离出两种阴离子,下列推断错误的是
A. 若某钠盐溶液含甲电离出的阴离子,则该溶液既可能与酸反应又可能与碱反应
B. 若乙与氧气的摩尔质量相同,则乙只能由2种元素组成
C. 若丙中含有第2周期IVA族的元素,则丙可能是甲烷的同系物
D. 若丁中各元素质量比跟甲中各元素质量比相同,则丁中一定含有-1价的元素
科目:高中化学 来源: 题型:
【题目】某化学小组以苯甲酸为原料,制取苯甲酸甲酯.已知有关物质的沸点如下表:
物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
沸点/℃ | 64.7 | 249 | 199.6 |
Ⅰ.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入9.6ml(密度约为1.27g.ml-1)苯甲酸和20mL甲醇(密度约0.79g·mL﹣1),再小心加入3mL浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品。
(1) 加入碎瓷片的作用是 ;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作时 (填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(2)浓硫酸的作用是 混合液体时最后加入浓硫酸的理由: 。
(3)甲、乙、丙三位同学分别设计了如图三套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去)。根据有机物的沸点最好采用装置 (填“甲”或“乙”或“丙”)。

Ⅱ.粗产品的精制
(4)苯甲酸甲酯粗产品中含有少量甲醇、硫酸、苯甲酸和水,现拟用下列流程进行精制,请根据流程图写出操作方法的名称,操作Ⅱ 。

(5)不能用NaOH溶液代替饱和碳酸钠溶液的原因是 。
(6)列式计算,苯甲酸甲酯的产率是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学反应与能量的说法中错误的是( ) 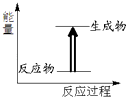
A.如图所示的反应为放热反应
B.化学反应中有物质变化也有能量变化
C.需要加热的化学反应不一定是吸热反应
D.化学键断裂吸收能量,化学键生成放出能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D、E、F的原子序数依次增大,它们的原子核外电子层数之和为13。B的化合物种类繁多,数目庞大;C、D是空气中含量最多的两种元素,D、E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期原子半径最小的元素。试回答以下问题:
(1)F元素名称为_______,在周期表中的位置是_____________。
(2)用电子式表示D与B以1:1的原子个数比形成的化合物的形成过程__________。
(3)化合物BD2中存在的化学键为_____键(填“离子”或“极性”或“非极性”)。A、C、F三种元素形成的化合物CA4F为______化合物(填“离子”或“共价”)。
(4)化合物甲、乙由A、B、D、E中的三种或四种组成。且甲、乙的水溶液均呈碱性,且乙可以用于治疗胃酸过多。则甲、乙反应的离子方程式为____________。
(5)A、C、D、E的原子半径由大到小的顺序是_________(用元素符号表示)。
(6)B的非金属性___于F(填“强”或“弱”),并用化学方程式证明上述结论:_________。
(7)B的最简单氢化物可作为燃料电池的___极,写出熔融碳酸钠介质中负极电极反应式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电动自行车由于灵活、快捷、方便,已成为上班族的主要代步工具,其电源常采用铅蓄电池。反应原理为:Pb(s)+PbO2(s)+2H2SO4(aq)![]() 2PbSO4(s)+2H2O(l)。根据此反应判断下列叙述错误的是( )
2PbSO4(s)+2H2O(l)。根据此反应判断下列叙述错误的是( )
A. 放电时负极反应为:Pb(s)+SO![]() (aq)-2e-===PbSO4(s)
(aq)-2e-===PbSO4(s)
B. 充电时电能转化为化学能
C. 放电时,电解液的密度增大
D. 充电时,电解液的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铜混合粉末20.0g加入到100mL 5.0 mol·L-1FeCl3溶液中,剩余固体质量为5.2g(忽略反应前后溶液体积变化)。求:
(1)反应后溶液中FeCl2的物质的量浓度_____________ mol·L-1
(2)原固体混合物中铜的质量分数是_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是
A.Al(OH)3可制作胃酸中和剂
B.食盐中加入KIO3可以防治碘缺乏症
C.硅是良好的半导体材料,二氧化硅可用于制造光导纤维
D.葡萄酒中加入少量SO2,这是利用了SO2的漂白性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com