
【题目】铁、铜混合粉末20.0g加入到100mL 5.0 mol·L-1FeCl3溶液中,剩余固体质量为5.2g(忽略反应前后溶液体积变化)。求:
(1)反应后溶液中FeCl2的物质的量浓度_____________ mol·L-1
(2)原固体混合物中铜的质量分数是_____________
【答案】 6.5 58%
【解析】试题分析:铁的金属性强于铜,氯化铁首先氧化铁,结合氯化铁的物质的量以及固体的质量分析判断铜部分参与反应,进而计算。
解析:(1)固体剩余,则氯化铁全部反应。如果铜不参与反应,根据氯离子守恒可知氯化亚铁的物质的量是0.1L×5mol/L×3/2=0.75mol,因此消耗铁是0.75mol-0.5mol=0.25mol,质量是14g,而固体减少质量是14.8g,所以铜部分反应。设混合溶液中氯化亚铁和氯化铜分别是xmol、ymol,则x+y=0.75、(x-0.5)×56+64y=20-5.2,解得x=0.65、y=0.1,因此反应后溶液中FeCl2的物质的量浓度0.65mol÷0.1L=6.5 mol·L-1。
(2)原固体混合物中铜的质量分数是![]() ×100%=58%。
×100%=58%。


科目:高中化学 来源: 题型:
【题目】反应4NH3+5O24NO+6H2O在5L的密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则下列反应速率正确的是( )
A.V(O2)=0.01molL﹣1s﹣1
B.V(NO)=0.008mol L﹣1s﹣1
C.V(H2O)=0.015mol L﹣1s﹣1
D.V(NH3)=0.002mol L﹣1s﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁4种物质分别含2种或3种元素,它们的分子中均含18个电子,甲是气态氢化物,在水中分步电离出两种阴离子,下列推断错误的是
A. 若某钠盐溶液含甲电离出的阴离子,则该溶液既可能与酸反应又可能与碱反应
B. 若乙与氧气的摩尔质量相同,则乙只能由2种元素组成
C. 若丙中含有第2周期IVA族的元素,则丙可能是甲烷的同系物
D. 若丁中各元素质量比跟甲中各元素质量比相同,则丁中一定含有-1价的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是煤化工产业链的一部分,试运用所学知识,解决下列问题: 
(1)已知该产业链中某反应的平衡表达式为:K= ![]() ,它所对应反应的化学方程式为;
,它所对应反应的化学方程式为;
(2)二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3 . 工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应: ①CO(g)+2H2(g)CH3OH(g)△H1=﹣90.7kJmol﹣1
②2CH3OH(g)CH3OCH3(g)+H2O(g)△H2=﹣23.5kJmol﹣1
③CO(g)+H2O(g)CO2(g)+H2(g)△H3=﹣41.2kJmol﹣1
(i)催化反应室中总反应的热化学方程式为 , 830℃时反应③的K=1.0,则在催化反应室中反应③的K1.0(填“>”、“<”或“=”).
(ii)在某温度下,若反应①的起始浓度分别为:c(CO)=1mol/L,c(H2)=2.4mol/L,5min后达到平衡,CO的转化率为50%,若反应物的起始浓度分别为:c(CO)=4mol/L,c(H2)=a mol/L;达到平衡后,c(CH3OH)=2mol/L,a=mol/L.
(iii)反应②在t℃时的平衡常数为400,此温度下,在0.5L的密闭容器中加入一定量的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
c/(molL﹣1) | 0.8 | 1.24 | 1.24 |
①此时刻,v正v逆(填“大于”、“小于”或“等于”).
②平衡时二甲醚的物质的量浓度是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某些简单有机物在一定条件下可发生如下转化,其中E(分子式C10H12O2)具有果香味:

请回答下列问题:
(1)F的分子式______________反应①的反应类型____________
(2)写出反应③的化学方程式________________________________________________
(3)下列说法中,正确的是_________
A. B分子中所有原子可能共平面 B.常温常压下物质B呈气态
C.1molB最多与4molH2发生加成 D.C与G是同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应可用CO32-+2H+===CO2↑+H2O表示的是( )
A. 向稀硫酸中加入CaCO3 B. 将盐酸滴在BaCO3上
C. 向盐酸中滴加Na2CO3溶液 D. 向盐酸中滴加NaHCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验装置可以达到实验目的的是( )
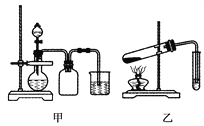
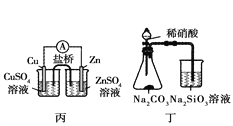
A. 甲装置可以实现Cl2的制取、收集、尾气吸收
B. 乙装置可以实现乙酸乙酯的制取和收集
C. 丙装置可以形成Cu—Zn原电池
D. 丁装置可证明H2CO3的酸性大于H2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种金属, B溶液能使酚酞试液变红,且焰色反应呈黄色;D、F相遇会产生白烟,生成NH4Cl。A、B、C、D、E、F间有如下变化关系:
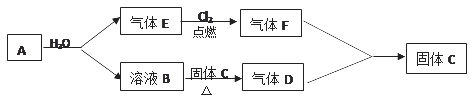
(1)A是________________;
(2)E在氯气中燃烧的实验现象是__________________;
(3)写出A→E、B反应的化学方程式:___________________;
(4)F在空气中遇水蒸气产生白雾现象,这白雾实际上是________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com