
【题目】如图是煤化工产业链的一部分,试运用所学知识,解决下列问题: 
(1)已知该产业链中某反应的平衡表达式为:K= ![]() ,它所对应反应的化学方程式为;
,它所对应反应的化学方程式为;
(2)二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3 . 工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应: ①CO(g)+2H2(g)CH3OH(g)△H1=﹣90.7kJmol﹣1
②2CH3OH(g)CH3OCH3(g)+H2O(g)△H2=﹣23.5kJmol﹣1
③CO(g)+H2O(g)CO2(g)+H2(g)△H3=﹣41.2kJmol﹣1
(i)催化反应室中总反应的热化学方程式为 , 830℃时反应③的K=1.0,则在催化反应室中反应③的K1.0(填“>”、“<”或“=”).
(ii)在某温度下,若反应①的起始浓度分别为:c(CO)=1mol/L,c(H2)=2.4mol/L,5min后达到平衡,CO的转化率为50%,若反应物的起始浓度分别为:c(CO)=4mol/L,c(H2)=a mol/L;达到平衡后,c(CH3OH)=2mol/L,a=mol/L.
(iii)反应②在t℃时的平衡常数为400,此温度下,在0.5L的密闭容器中加入一定量的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
c/(molL﹣1) | 0.8 | 1.24 | 1.24 |
①此时刻,v正v逆(填“大于”、“小于”或“等于”).
②平衡时二甲醚的物质的量浓度是 .
【答案】
(1)C(s)+H2O(g)?CO(g)+H2(g)
(2)3CO(g)+3H2(g)?CH3OCH3(g)+CO2(g)△H=﹣247kJ?mol﹣1;>;5.4;大于;1.6mol/L
【解析】解:(1)化学平衡常数K等于生成物浓度幂之积与反应物浓度幂之积的比,根据元素守恒知,反应物中还含有固体碳,由化学平衡常数表达式知,该反应方程式为C(s)+H2O(g)CO(g)+H2(g),所以答案是:C(s)+H2O(g)CO(g)+H2(g);(2)(i)①CO(g)+2H2(g)CH3OH(g)△H1=﹣90.7kJmol﹣1②2CH3OH(g)CH3OCH3(g)+H2O(g)△H2=﹣23.5kJmol﹣1③CO(g)+H2O(g)CO2(g)+H2(g)△H3=﹣41.2kJmol﹣1将方程式①×2+②+③得3CO(g)+3H2(g)CH3OCH3(g)+CO2(g),△H=2(﹣90.7kJmol﹣1)+(﹣23.5kJmol﹣1)+(﹣41.2kJmol﹣1)=﹣247kJmol﹣1 , ③的正反应是放热反应,降低温度平衡正向移动,化学平衡常数增大,所以在催化反应室中反应③的K>1.0, 所以答案是:3CO(g)+3H2(g)CH3OCH3(g)+CO2(g)△H=﹣247kJmol﹣1;>;
(ii)该反应中
CO(g)+ | 2H2(g) | CH3OH(g) | ||
开始(mol/L) | 1 | 2.4 | 0 | |
反应(mol/L) | 1×50% | 1×50%×2 | 1×50% | |
平衡(mol/L) | 0.5 | 1.4 | 0.5 |
化学平衡常数K= ![]() =
= ![]() ,
,
温度不变化学平衡常数K不变,
该反应中
CO(g)+ | 2H2(g) | CH3OH(g) | ||
开始(mol/L) | 4 | a | 0 | |
反应(mol/L) | 2 | 4 | 2 | |
平衡(mol/L) | 2 | a﹣4 | 2 |
化学平衡常数K= ![]() =
= ![]() ,
,
a=5.4,
所以答案是:5.4;
(iii)①浓度商= ![]() =2.4<400,平衡正向移动,则v正 大于 v逆 ,
=2.4<400,平衡正向移动,则v正 大于 v逆 ,
所以答案是:大于;
②设达到平衡时二甲醚反应的物质的量浓度为xmol/L,
该反应
2CH3OH(g) | CH3OCH3(g)+ | H2O | ||
开始(mol/L) | 0.8 | 1.24 | 1.24 | |
反应(mol/L) | 2x | x | x | |
平衡(mol/L) | 0.8﹣2x | 1.24+x | 1.24+x |
化学平衡常数K= ![]() =400
=400
x=0.36,
则平衡时二甲醚的物质的量浓度=(1.24+0.36)mol/L=1.6mol/L,
所以答案是:1.6mol/L.
【考点精析】本题主要考查了化学平衡状态本质及特征和化学平衡的计算的相关知识点,需要掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能正确解答此题.


科目:高中化学 来源: 题型:
【题目】关于化学反应与能量的说法中错误的是( ) 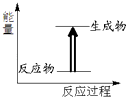
A.如图所示的反应为放热反应
B.化学反应中有物质变化也有能量变化
C.需要加热的化学反应不一定是吸热反应
D.化学键断裂吸收能量,化学键生成放出能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D、E、F的原子序数依次增大,它们的原子核外电子层数之和为13。B的化合物种类繁多,数目庞大;C、D是空气中含量最多的两种元素,D、E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期原子半径最小的元素。试回答以下问题:
(1)F元素名称为_______,在周期表中的位置是_____________。
(2)用电子式表示D与B以1:1的原子个数比形成的化合物的形成过程__________。
(3)化合物BD2中存在的化学键为_____键(填“离子”或“极性”或“非极性”)。A、C、F三种元素形成的化合物CA4F为______化合物(填“离子”或“共价”)。
(4)化合物甲、乙由A、B、D、E中的三种或四种组成。且甲、乙的水溶液均呈碱性,且乙可以用于治疗胃酸过多。则甲、乙反应的离子方程式为____________。
(5)A、C、D、E的原子半径由大到小的顺序是_________(用元素符号表示)。
(6)B的非金属性___于F(填“强”或“弱”),并用化学方程式证明上述结论:_________。
(7)B的最简单氢化物可作为燃料电池的___极,写出熔融碳酸钠介质中负极电极反应式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电动自行车由于灵活、快捷、方便,已成为上班族的主要代步工具,其电源常采用铅蓄电池。反应原理为:Pb(s)+PbO2(s)+2H2SO4(aq)![]() 2PbSO4(s)+2H2O(l)。根据此反应判断下列叙述错误的是( )
2PbSO4(s)+2H2O(l)。根据此反应判断下列叙述错误的是( )
A. 放电时负极反应为:Pb(s)+SO![]() (aq)-2e-===PbSO4(s)
(aq)-2e-===PbSO4(s)
B. 充电时电能转化为化学能
C. 放电时,电解液的密度增大
D. 充电时,电解液的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示.下列说法错误的是( ) 
A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铜混合粉末20.0g加入到100mL 5.0 mol·L-1FeCl3溶液中,剩余固体质量为5.2g(忽略反应前后溶液体积变化)。求:
(1)反应后溶液中FeCl2的物质的量浓度_____________ mol·L-1
(2)原固体混合物中铜的质量分数是_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全球环境问题按其相对的严重性,排在前三位的是( )
A.全球增温问题,臭氧空洞问题,酸雨问题
B.海洋污染问题,土壤荒漠化问题,物种灭绝
C.森林面积减少,饮用水污染问题,有害废弃物越境迁移
D.饮用水污染问题,土壤荒漠化问题,噪声污染问题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com