
【题目】现有三组溶液:①汽油和食盐水溶液;②75%的乙醇溶液;③单质溴和氯化钠的水溶液。分离以上各混合液的正确方法依次是( )
A. 分液、萃取、蒸馏 B. 萃取、蒸馏、分液
C. 蒸馏、萃取、分液 D. 分液、蒸馏、萃取
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】甲苯氧化法制备苯甲酸的反应原理如下: 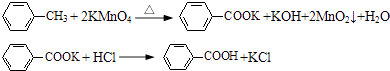
实验时将一定量的甲苯和KMnO4溶液置于图1装置中,在100℃时,反应一段时间,再停止反应,并按如下流程分离出苯甲酸和回收未反应的甲苯.
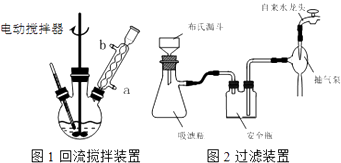
(1)实验室中实现操作Ⅰ所需的玻璃仪器有、烧杯;操作Ⅱ的名称为 .
(2)如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,若无此操作会出现的危害是 .
(3)在操作Ⅲ中,抽滤前需快速冷却溶液,其原因是;如图2所示抽滤完毕,应先断开橡皮管.
(4)纯度测定:称取1.220g产品,配成100mL溶液,取其中25.00mL溶液,进行滴定,消耗KOH物质的量为2.4×10﹣3 mol.产品中苯甲酸质量分数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,某化合物X受热分解:2X=A↑+2B↑+4C↑。测得反应后生成的混合气体对H2的相对密度为d,在相同条件下,X的相对分子质量是
A. 2d B. 7d C. 5d D. 3.5d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化硼是一种重要的化工原料,某同学设计的三氯化硼制备装置如图. 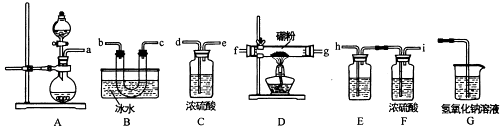
【查阅资料】
①BCl3:的熔点为﹣107.3℃,沸点为12.5℃
②2B+6HCl ![]() 2BCl3+3h2
2BCl3+3h2
③硼与侣的性质相似,也能与氢氧化钠溶液反应
请回答下列题:
(1)A装置可用高高锰酸钾固体与浓盐酸反应制氯气,反应的化学方程式为 .
(2)为了完成三氯化硼的制备,装置从左到右的接口连接顺序为 .
(3)装里E中的试剂为 . 如果拆去E装置,可能的后果是 .
(4)D装置中发生反应前先通入一段时间的氯气,其目的是 . 该装置中发生反应的化学方程式为 .
(5)三氯化硼与水能剧烈反应生成硼酸(H3BO3)和白雾,写出该反应的化学方程式 .
(6)请设计一个简易实验,验证制得的产品中是否含有硼粉 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 |
n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=;若其他条件不变,容器体积缩小为1L,则K值 . (增大、减小或不变);若K300°C>K350°C , 则该反应是热反应.
(2)用O2表示从0~2s内该反应的平均速率v=;
(3)能说明该反应已达到平衡状态的是
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是
a.及时分离除NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效催化剂.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下纯水中的c(H+)=2×10﹣7molL﹣1 , 则此时水中的c(OH﹣)=;若温度不变,滴入稀盐酸,使c(H+)=5×10﹣4molL﹣1 , 则此时溶液中由水电离产生的c(OH﹣)= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铜是一种黑色固体,可溶于稀硫酸。某同学想知道稀硫酸中的哪种粒子(H2O、H+、SO42-)能使氧化铜溶解。请你和他一起通过下图所示Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动。
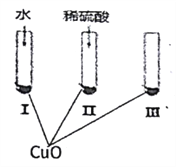
(1)通过实验I可以证明___________________。
(2)要证明另外两种粒子能否溶解氧化铜,还需要进行实验Ⅱ和Ⅲ,在Ⅱ中加入稀硫酸后氧化铜溶解,则进一步确认的实验操作是:在Ⅲ中先加入__________,再加入_________。
(3)探究结果为__________ 。
(4)反应的离子方程式为__________。
【答案】 水不能使氧化铜溶解 可溶性硫酸盐 稀硫酸 H+能溶解氧化铜,而H2O、SO42-两种离子都不能使CuO溶解 CuO+2H+=Cu2++H2O
【解析】(1)实验Ⅰ的试管中的液体成分为水,该实验证明水不溶解CuO;
(2)要想证明起作用的是H+,首先要排除SO42-的干扰,所以在Ⅲ中应该加入可溶性硫酸盐,如Na2SO4(或K2SO4等),最后再加放稀硫酸;
(3)通过对比实验验证起作用的成分,得出结论是:氧化铜固体溶于稀H2SO4是稀硫酸H+在起作用,而H2O、SO42-两种粒子都不能使CuO溶解;
(4)CuO与硫酸电离的氢离子反应生成铜离子和水,反应的离子方程式为:CuO+2H+=Cu2++H2O。
点睛:性质实验方案设计的一般思路、程序是: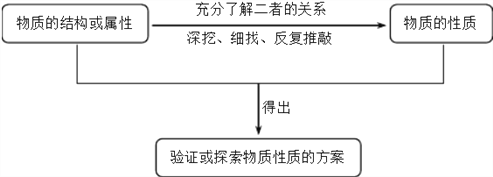 。
。
【题型】实验题
【结束】
28
【题目】(1)己知: 将Cl2通入适量KOH 溶液,产物中可能有KC1、KClO、KC1O3,且c(Cl-):c(C1O-)的值与温度高低有关。当n(KOH)=amol时,若某温度下,反应后c(Cl-):c(C1O-)=11,则溶液中c(ClO-):c(ClO3-)=__________。
(2)在P+CuSO4+H2O→CuP+H3PO4+H2SO4(未配平)的反应中,7.5molCuSO4 可氧化P的物质的量为_______mol。生成1molCu3P时,参加反应的P 的物质的量为_______mol。
(3)一定量的CuS和Cu2S 的混合物投入足量的HNO3中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+和SO42-) 加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO16.0g,若上述气体为NO和NO2的混合物,且体积比为1:1,则V的极小值为______L。
(4)向一定量的Fe、FeO、Fe3O4的混合物中,加入1mol/L 硝酸的溶液100mL,恰好使混合物全部溶解,且放出336mLNO (标准状况下),向所得溶液中加入KSCN 溶液,溶液无红色出现; 若取相同质量的Fe、FeO、Fe3O4的混合物,加入1mol/L 的稀硫酸溶液,也恰好使混合物完全溶解(假设还原产物唯一),反应后向所得溶液中加入KSCN溶液,溶液也无红色出现,则所加入的的稀硫酸的体积是______mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室常用的部分仪器,请回答下列问题

(1)序号为⑧和⑩的仪器名称分别为__________、__________。
(2)在分液操作中,必须用到上述仪器中的________(填序号)。
(3)能作反应仪器且可直接加热的仪器上述中的___________(填名称)。
(4)在配制一定物质的量浓度的溶液时,需要用到的仪器是___________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图1是细胞中3种化合物含量的扇形图,图2是有活性的细胞中元素含量的柱形图,下列说法不正确的是( )

A. 若图1表示正常细胞,则A、B化合物共有的元素中含量最多的是a
B. 若图1表示细胞完全脱水后化合物含量的扇形图,则A化合物中含量最多的元素为图2中的b
C. 图2的正常细胞中数量最多的元素是c,这与细胞中含量最多的有机物有关
D. 若图1表示正常细胞,则B化合物具有多样性,其必含的元素为C、H、O、N、P
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com