
【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 |
n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=;若其他条件不变,容器体积缩小为1L,则K值 . (增大、减小或不变);若K300°C>K350°C , 则该反应是热反应.
(2)用O2表示从0~2s内该反应的平均速率v=;
(3)能说明该反应已达到平衡状态的是
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是
a.及时分离除NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效催化剂.
【答案】
(1)![]() ;不变;放
;不变;放
(2)1.5×10﹣3mol?L﹣1?s﹣1
(3)bcd
(4)c
【解析】解:(1)平衡常数表达式等于生成物的浓度幂之积比上反应物的浓度幂之积;平衡常数k与温度有关,压强改变不影响k,所以k不变;温度升高k变小,说明反应逆向移动,即逆方向是吸热方向,该反应是放热反应.
所以答案是: ![]() ;不变;放;(2)2s内用NO表示的平均反应速率v(NO)=
;不变;放;(2)2s内用NO表示的平均反应速率v(NO)= ![]() =3.0×10﹣3molL﹣1s﹣1 , 速率之比等于化学计量数之比,所以v(O2)=
=3.0×10﹣3molL﹣1s﹣1 , 速率之比等于化学计量数之比,所以v(O2)= ![]() v(NO)=
v(NO)= ![]() ×3.0×10﹣3molL﹣1s﹣1=1.5×10﹣3molL﹣1s﹣1 .
×3.0×10﹣3molL﹣1s﹣1=1.5×10﹣3molL﹣1s﹣1 .
所以答案是:1.5×10﹣3molL﹣1s﹣1(3)a.若反应达到平衡,则v(NO2)正=2v(O2)逆 , 现在速率的正、逆为指明,因此不能判断反应是否达到平衡,故a错误;
b.由于该反应是反应前后气体体积不等的反应,所以若容器内压强保持不变,则反应达到平衡,故b正确;
c.v逆(NO)=2v正(O2),则NO、O2的浓度不变,反应达到平衡,故c正确;
d.容器内温度保持不变,说明参加生成的三氧化硫的物质的量不再变化,反应到达平衡,故d正确.
所以答案是:bcd;(4)a.及时分离除NO2气体平衡向右移动,但反应速率减小,故错误;
b.适当升高温度,反应速率增大但平衡向逆反应方向移动,故错误;
c.增大O2的浓度反应速率增大,且该反应向正反应方向移动,故正确;
d.选择高效催化剂能增大反应速率,但平衡不移动,故错误;
所以答案是:c.
【考点精析】通过灵活运用化学平衡状态的判断和化学平衡的计算,掌握状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等;反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%即可以解答此题.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】常温下,向20mL的某稀H2S04溶液中滴入0.1mol/L氨水,溶液中水电离出氢离子浓度随滴人氨水体积变化如图.下列分析正确的是( ) 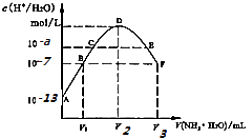
A.稀硫酸的浓度为0.1mol/L
B.C点溶液pH=14﹣a
C.E溶液中存在:c(NH4+)>c(SO42﹣)>c(H+)>c(OH﹣)
D.B到D、D到F所加氨水体积一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,△H能正确表示物质的燃烧热的是( )
A.CO(g)+ ![]() O2(g)═CO2(g);△H=﹣283.0 kJ/mol
O2(g)═CO2(g);△H=﹣283.0 kJ/mol
B.C(s)+ ![]() O2(g)═CO(g);△H=﹣110.5 kJ/mol
O2(g)═CO(g);△H=﹣110.5 kJ/mol
C.H2(g)+ ![]() O2(g)═H2O(g);△H=﹣241.8 kJ/mol
O2(g)═H2O(g);△H=﹣241.8 kJ/mol
D.2C8H18(l)+25O2(g)═16CO2(g)+18H2O(l);△H=﹣11036 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,6一己二酸(G)是合成尼龙的主要原料之一,可用烃A氧化制备.制备G的合成路线如图1:
回答下列问题:
(1)化合物A的质谱图如图2,则A的化学名称为 .
(2)C→D的反应类型为 .
(3)F的结构简式为 .
(4)由G合成尼龙的化学方程式为 .
(5)由A通过两步反应制备1,3﹣环己二烯的合成路线为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 |
n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=;若其他条件不变,容器体积缩小为1L,则K值 . (增大、减小或不变);若K300°C>K350°C , 则该反应是热反应.
(2)用O2表示从0~2s内该反应的平均速率v=;
(3)能说明该反应已达到平衡状态的是
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是
a.及时分离除NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效催化剂.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的NaOH 溶液中逐滴加入AlCl3溶液,生成沉淀A1(OH)3的量随AlCl3加入量的变化关系如右图所示。则下列离子组在对应的溶液中一定能大量共存的是

A. a点对应的溶液中:Na+、Fe3+、SO42-、HCO3-
B. b点对应的溶液中:Na+、S2-、SO42-、Cl-
C. c点对应的溶液中:Ag+、Ca2+、NO3-、F-
D. d点对应的溶液中:K+、NH4+、I-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
B. 蔗糖、硫酸钠和水分别属于非电解质、强电解质和弱电解质
C. 点燃的镁条不能在二氧化碳气体中继续燃烧
D. 含0.2molH2SO4的浓硫酸与足量的铜反应,生成标准状况下的气体2.24L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组的同学拟利用碘化亚铁与碳酸氢钠的反应来制备高纯度的碘化钠晶体.回答下列问题:
(1)碘化亚铁溶液的制备:将碘和铁粉按物质的量之比在 ![]() ﹣
﹣ ![]() 之间配料,加入三颈烧瓶中(如图),然后加入适量水,并向装置中持续通入N2 , 在40﹣60℃下搅拌反应30﹣50min,待反应完成检验出反应液中不含碘单质后,过滤即制得碘化亚铁溶液. ①配料中铁粉过量的目的是;持续通入N2的目的是 .
之间配料,加入三颈烧瓶中(如图),然后加入适量水,并向装置中持续通入N2 , 在40﹣60℃下搅拌反应30﹣50min,待反应完成检验出反应液中不含碘单质后,过滤即制得碘化亚铁溶液. ①配料中铁粉过量的目的是;持续通入N2的目的是 .
②检验反应液中不含碘单质的方法是 .
(2)碘化钠溶液的制备:将制备好的碘化亚铁溶液加入碳酸氢钠溶液中,控制碘化亚铁与碳酸氢钠的物质的量之比在 ![]() ∽
∽ ![]() ,在80﹣100℃下,反应30﹣50min,反应生成碘化钠及硫酸亚铁等.该反应的化学方程式为 .
,在80﹣100℃下,反应30﹣50min,反应生成碘化钠及硫酸亚铁等.该反应的化学方程式为 .
(3)点化钠的提纯与结晶: ①除去碘化钠溶液中以HCO3﹣的方法是 .
②从碘化钠溶液中获得碘化钠晶体(20℃时溶解度为179/100g水,100℃时溶解度为302/100g水)的操作方法是 .
(4)碘化钠的提度的测定: 该小组同学称取制得的碘化钠晶体18.1g,溶于水后加入50mL2.5mol/LAgNO3溶液,过滤、洗涤、干燥,称得沉淀的质量为28.2g.则碘化钠晶体的纯度为 . (杂质不参与反应,结果保留至小数点后两位)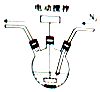
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com