
【题目】下列物质与水反应,能放出氧气的是( )
A. Na B. Na2O C. Na2O2 D. NO2
科目:高中化学 来源: 题型:
【题目】仔细阅读题意,根据要求填空
(1)Ⅰ.物质的量浓度相同的 ①氨水 ②氯化铵 ③碳酸氢铵 ④硫酸氢铵 ⑤硫酸铵 五种溶液中c(NH4+)大小的顺序是(填序号) II.乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务.
该组同学的研究课题是:探究测定草酸晶体(H2C2O4xH2O)中的x值.通过查阅资料和网络查寻得,草酸易溶于水,水溶液可以用酸性KMnO4溶液进行滴定:
2MnO ![]() +5H2C2O4+6H+═2Mn2++10CO2↑+8H2O
+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O
学习小组的同学设计了滴定的方法测定x值.
①称取1.260g纯草酸晶体,将其制成100.00mL水溶液为待测液.
②取25.00mL待测液放入锥形瓶中,再加入适量的稀H2SO4 .
③用浓度为0.1000molL﹣1的KMnO4标准溶液进行滴定,达到终点时消耗10.00mL.
滴定时,将酸性KMnO4标准液装在如图中的(填“甲”或“乙”)滴定管中.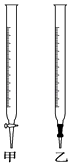
(2)本实验滴定达到终点的标志可以是 .
(3)通过上述数据,求得x= . 讨论:①若滴定终点时俯视滴定管刻度,则由此测得的x值会(填“偏大”、“偏小”或“不变”,下同).
②若滴定时所用的酸性KMnO4溶液因久置而导致浓度变小,则由此测得的x值会 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 标准状况下,1 mol H2O所占的体积为22.4L B. 阿伏加德罗常数约等于6.02×1023 mol-1
C. 钠的摩尔质量等于它的相对原子质量 D. H2O的摩尔质量是18 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol碳完全燃烧后可放出393.5KJ的热量,下列热化学方程式正确的是( )
A.C(s)+O2(g)=CO2(g)△H=+393.5 kJ/mol
B.C(s)+ ![]() O2(g)=CO(g)△H=﹣393.5 kJ/mol
O2(g)=CO(g)△H=﹣393.5 kJ/mol
C.C+O2=CO2△H=﹣393.5 kJ/mol
D.C(s)+O2(g)=CO2(g)△H=﹣393.5 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质所含原子个数按由大到小的顺序排列的是
①0.5molNH3 ②1molHe ③0.5molH2O ④0.2molH3PO4
A. ①④③② B. ④③②① C. ②③④① D. ①④②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NaCl等为原料制备KClO4的过程如下: ①在无隔膜、微酸性条件下,发生反应:NaCl+H2O﹣NaClO3+H2↑(未配平)
②在NaClO3溶液中加入KCl发生复分解反应,降温结晶,得KClO3 .
③一定条件下反应:4KClO3 ![]() 3KClO4+KCl,将产物分离得到KClO4 .
3KClO4+KCl,将产物分离得到KClO4 .
(1)电解时,产生质量为2.13g NaClO3 , 同时得到H2的体积为L(标准状况).
(2)向NaClO3溶液中加入KCl能得到KClO3的原因是 .
(3)该过程制得的KClO4样品中含少量KCl杂质,为测定产品纯度进行如下实验: 准确称取5.689g样品溶于水中,配成250mL溶液,从中取出25.00mL于锥形瓶中,加入适量葡萄糖,加热使ClO4﹣全部转化为Cl﹣(反应为:3KClO4+C6H12O6═6H2O+6CO2↑+3KCl),加入少量K2CrO4溶液作指示剂,用0.20mol/L AgNO3溶液进行滴定至终点,消耗AgNO3溶液体积为21.00mL.滴定达到终点时,产生砖红色Ag2CrO4沉淀.
①已知:Ksp(AgCl)=1.8×10﹣10 , Ksp(Ag2CrO4)=1.1×10﹣12 , 若c(CrO42﹣)=1.1×10﹣4mol/L,则此时c(Cl﹣)=mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】提纯含有少量泥沙的粗盐,下列操作顺序正确的是
A. 溶解、过滤、蒸发、结晶 B. 过滤、蒸发、结晶、溶解
C. 溶解、蒸发、过滤、结晶 D. 溶解、蒸发、结晶、过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 |
n(NO)(mol) | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=;若其他条件不变,容器体积缩小为1L,则K值 . (增大、减小或不变);若K300°C>K350°C , 则该反应是热反应.
(2)用O2表示从0~2s内该反应的平均速率v=;
(3)能说明该反应已达到平衡状态的是
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是
a.及时分离除NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效催化剂.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com