
【题目】下列关于常见有机物的说法正确的是
A.乙烯和苯都能和溴水发生化学反应而使溴水褪色
B.乙烷可使酸性高锰酸钾溶液褪色
C.糖类和蛋白质都是高分子化合物
D.乙酸和油脂都能与氢氧化钠溶液反应
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】铜及其化合物在日常生活中应用广泛。某研究性学习小组欲从氯化铁溶液腐蚀印刷电路极后的酸性废液中(含FeCl3、FeCl2含CuCl2)制备氯化铜晶体(CuCl2·2H2O),设计路线如下:
![]()
回答下列问题:
(1)检验酸性废液中含有Fe3+,常用的试剂是 (填化学式);酸性废液中加入足量Cl2,反应的化学方程式为 。
(2)操作1的名称是 ;调节溶液的pH时适宜选用下列试剂中的 ;
A.NaOH溶液 B.Na2CO3 C.氨水 D.CuO
若调节溶液的pH为4时,溶液中残留的Fe3+物质的量浓度为 (已知25℃时,Kap[Fe(OH)3]=4×10-38).
(3)操作2需在氯化氢气流中经过加热浓缩、 、过滤、洗涤、干燥。在氯化氢气流中进行操作的原因是 (结合离子方程式并简要说明)。
(4)若在溶液2中通入一定量的SO2,加热,则生成CuCl沉淀,该反应的离子方程式为 。
(5)该小组设想以铜棒和石墨棒为电极,以KI溶液为电解液,利用电解来制取碘化亚铜,
已知:2Cu2++4I-=2CuI↓+I2.若按其设想,铜棒应连接电源的 (填“正”或“负”)极;阴极发生的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂被誉为“金属味精”,以LiCoO2为正极材料的锂离子电池已被广泛用作便携式电源。工业上常以β锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂。其中一种工艺流程如下:
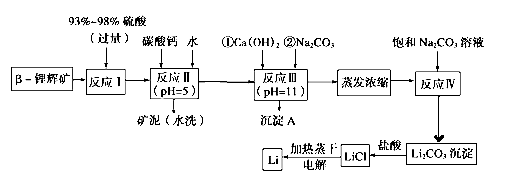
已知:
①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 2.7 | 3.7 | 9.6 |
完全沉淀pH | 3.7 | 4.7 | 11 |
②Li2CO3在不同温度下的溶解度如下表:
温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
请回答下列问题:
(1)用氧化物形式表示LiAlSi2O6的组成:_______________________
(2)反应Ⅱ加入碳酸钙的作用是____________________
(3)写出反应Ⅲ中生成沉淀A的离子方程式:____________________
(4)洗涤所得Li2CO3沉淀要使用“热水”还是“冷水”理由是____________________
(5)流程中两次使用了Na2CO3溶液,第一次浓度小,第二次浓度大的原因是____________________
(6)该工艺中,电解熔融氯化锂生产锂时,阳极产生的氯气中会混有少量氧气,原因是____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关非金属及其化合物的说法正确的是( )
A. 硅酸可使紫色石蕊试液变红色
B. 二氧化硫通入紫色石蕊试液中.试液先变红后褪色
C. 可用锌粒与稀硝酸反应制备氢气
D. 液溴易挥发,所以存放液溴的试剂瓶中应加水封保存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关油脂的叙述中,错误的是
A.油脂分子结构中三个烃基一定相同
B.可以用纯碱溶液去除油污
C.可以用纯碱区别植物油和柴油
D.工业上可用油脂制造高级脂肪酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁粉放入由盐酸、MgCl2溶液、FeCl3溶液、CuCl2溶液组成的混合液中,充分反应后,铁粉有剩余,则溶液中含有的阳离子是( )
A. Cu2+和Fe2+ B. H+和Cu2+ C. Fe3+和Fe2+ D. Fe2+和Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
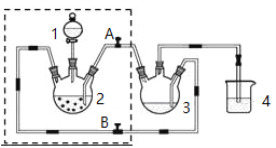
【题目】实验室制备醋酸亚铬水合物的装置如图所示, 涉及的化学方程式如下:
Zn(s)+2HCl(aq)= ZnCl2(aq)+H2(g);
2CrCl3(aq)+Zn(s)= 2CrCl2(aq)+ZnCl2(aq)
2Cr2+(aq)+4CH3COO﹣(aq)+2H2O(l)=[Cr(CH3COO)2]22H2O (s)
醋酸亚铬水合物([Cr(CH3COO)2)]22H2O,深红色晶体)是一种氧气吸收剂,通常以二聚体分子存在,不溶于冷水和醚,微溶于醇,易溶于盐酸。
请回答下列问题:
(1)检查虚框内装置气密性的方法是_____________________________________。
(2)本实验中所有配制溶液的水需煮沸,其原因是_________________________________。装置4的作用是_________________________。
(3)将生成的CrCl2溶液与CH3COONa溶液混合时的操作是_________阀门A、__________阀门B (填“打开”或“关闭”)。
(4)本实验中锌粒须过量,其原因是__________________________________。
(5)为洗涤[Cr(CH3COO)2)]22H2O产品,下列方法中最适合的是________________。
A.先用盐酸洗,后用冷水洗
B.先用冷水洗,后用乙醇洗
C.先用冷水洗,后用乙醚洗
D.先用乙醇洗涤,后用乙醚洗
(6)铬元素在很多领域都有应用。氯化铬酰(CrO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。写出铬元素的基态原子外围电子排布式:_________________;与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有_______________(填名称);CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是________(填“极性”或“非极性”)分子。
查看答案和解析>>
科目:高中化学 来源: 题型:
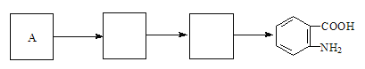
【题目】【化学—选修5 有机化学基础】
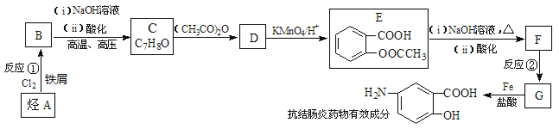
某抗结肠炎药物有效成分的合成路线如下(部分反应略去试剂和条件):
已知: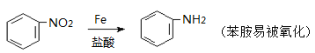
请回答下列问题:
(1)抗结肠炎药物有效成分的分子式是: ;烃A的名称为: ;反应②的反应类型是: 。
(2)①下列对该抗结肠炎药物有效成分可能具有的性质推测正确的是: ;
A.水溶性比苯酚好
B.能发生消去反应也能发生聚合反应
C.1mol该物质最多可与4mol H2发生反应
D.既有酸性又有碱性
② E与足量NaOH溶液反应的化学方程式是: 。
(3)符合下列条件的抗结肠炎药物有效成分的同分异构体有______种。
A.遇FeCl3溶液有显色反应
B.分子中甲基与苯环直接相连
C.苯环上共有三个取代基
(4)已知:苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位,据此按先后顺序写出以A为原料合成邻氨基苯甲酸(![]() )合成路线中两种中间产物的结构简式(部分反应条件已略去)
)合成路线中两种中间产物的结构简式(部分反应条件已略去)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com