
【题目】A、B、C、D、E、F是前四周期原子序数依次增大的六种元素。A元素原子的核外电子数等于其电子层数,B元素基态原子有三个能级且各能级电子数相同,A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1,E元素原子的K、L层电子数之和等于其M、N层电子数之和,F被称为继铁、铝之后的第三金属,具有良好的生物亲和性,还可用于制造飞机、火箭、人造卫星、宇宙飞船等领域。请回答下列各题(涉及元素请用相应化学符号表示):
(1)B、C、D中第一电离最大的元素其基态原子有________种不同能量的电子。
(2)G分子中D原子的杂化方式为_______,F2+的基态价电子排布式为_________。
(3)BA3-离子的空间构型为________,与其互为等电子体的一种阳离子的电子式为__________。
(4)某化合物晶胞结构如图所示,E2+的最近且等距的D2-有_________个。KIO3晶体是一种性能良好的非线性光学材料,具有与右图相似的立体结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,K与O间的最短距离为______nm。

(5)用高能射线照射液态H时,一个H分子能释放出一个电子,同时产生一种阳离子。释放出来的电子可以被若干H分子形成的“网”捕获,你认为H分子间能形成“网”的原因________________。且由H分子释放出电子时产生的该种阳离子具有较强的氧化性,试写出该阳离子与S02的水溶液反应离子方程式_____________。
【答案】 3 sp3 3d2 三角锥形 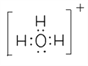 6 0.315(或0.223) 水分子间存在氢键 2H2O+ + SO2 ==== 4H+ + SO42—
6 0.315(或0.223) 水分子间存在氢键 2H2O+ + SO2 ==== 4H+ + SO42—
【解析】A、B、C、D、E、F是前四周期原子序数依次增大的六种元素,A元素原子的核外电子数等于其电子层数,A为H元素;B元素基态原子有三个能级且各能级电子数相同,核外电子排布式为1s22s22p2,B为碳元素;A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1,则D为O元素、G为H2O2、H为H2O;C的原子序数介于碳、氧之间,则C为N元素;E元素原子的K、L层电子数之和等于其M、N层电子数之和,原子核外电子数为(2+8)×2=20,则E为Ca;F被称为继铁、铝之后的第三金属,可用于制造飞机、火箭、人造卫星、宇宙飞船等领域,则F为Ti。
(1)C、N、O中第一电离最大的元素为N元素,其基态原子核外电子排布式为1s22s22p3,有3种不同能量的电子;(2)G为H2O2,O原子形成2个σ键、含有2对孤对电子,杂化轨道数目为sp3,O原子杂化方式为sp3,Ti2+的基态价电子排布式为3d2;(3)CH3-离子中C原子孤电子对数=(4+11×3)/2=1,价层电子对数=3+1=4,故离子的空间构型为三角锥形,与其互为等电子体的一种阳离子为H3O+,电子式为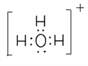 ;(4)某化合物晶胞结构如图所示,E2+位于体心与面心的D2-离子相邻,E2+的最近且等距的D2-有6个;根据晶胞结构,K与O间的最短距离是面对角线的一半,即为
;(4)某化合物晶胞结构如图所示,E2+位于体心与面心的D2-离子相邻,E2+的最近且等距的D2-有6个;根据晶胞结构,K与O间的最短距离是面对角线的一半,即为![]() nm=0.315nm;如果晶胞中K、I、O分别处于体心、顶角、面心位置,则K与O间的最短距离为边长的一半,即为0.223nm。(5)用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种阳离子为H2O+;水分子间能形成“网”的原因是:水分子间存在氢键;由H分子释放出电子时产生的一种阳离子具有较强的氧化性,该阳离子与SO2水溶液反应离子方程式为:2H2O+ +SO2=4H+ + SO42-。
nm=0.315nm;如果晶胞中K、I、O分别处于体心、顶角、面心位置,则K与O间的最短距离为边长的一半,即为0.223nm。(5)用高能射线照射液态水时,一个水分子能释放出一个电子,同时产生一种阳离子为H2O+;水分子间能形成“网”的原因是:水分子间存在氢键;由H分子释放出电子时产生的一种阳离子具有较强的氧化性,该阳离子与SO2水溶液反应离子方程式为:2H2O+ +SO2=4H+ + SO42-。


科目:高中化学 来源: 题型:
【题目】根据热化学方程式:S(l)+O2(g)=SO2(g) △H=-293.23kJ·mol-1,分析下列说法中正确的是
A.硫和氧气反应放出293.23kJ的热量
B.一个硫原子和一个氧气分子完全反应放出293.23kJ的热量
C.1摩尔硫单质和1摩尔氧气完全反应生成1摩尔二氧化硫放出293.23kJ的热量
D.1摩尔液体硫磺和1摩尔气态氧气完全反应生成1摩尔二氧化硫气体放出293.23kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 1mol任何物质都含有6.02×1023个原子
B. 0.012kg12C含有约6.02×1023个碳原子
C. 硫酸的摩尔质量是98g
D. 常温常压下,1mol氧气的体积为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在可逆反应中,改变下列条件一定能加快反应速率的是( )
①增大反应物浓度 ②升高温度 ③增大压强 ④使用催化剂 ⑤增大体积
A.全部B.①②C.①②③D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是应用最广泛的金属,铁的氯化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)在实验室中,FeCl2可用铁粉和_____________(填名称)反应制备,FeCl3可用铁粉和____________(填化学式)反应制备。
(2)Fe3O4可用多种方法制得,其中由一种单质和一种化合物通过化合反应制备的化学方程式为 _____________________________________________________。
(3)红砖是用黏土高温烧结而成的,因其含有Fe2O3呈红色或棕红色而得名,常用作建筑材料。请设计一个简单实验证明红砖中含有Fe2O3:_________________________________________________。
(4)现有一含有FeCl2 和FeCl3的混合样品,实验测得n(Fe)∶n(Cl)=1∶2.1,则该样品中FeCl3 的物质的量分数为_________。
(5)FeCl3和HI(氢碘酸、强酸)反应时,I-转化为I2,请写出该反应的离子方程式:_________________;
(6)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,下列分析正确的是

A. K1闭合,铁棒上发生的反应为2H++2e-=H2↑
B. K1闭合,石墨棒周围溶液pH逐渐升高
C. K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D. K2闭合,电路中通过0.002 NA个电子时,两极共产生0.001 mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化必须加入氧化剂且通过一步反应就能完成的是 ( )
①NO2→NO ②NO2→HNO3 ③N2→NO2 ④N2→NO ⑤N2→NH3
A. ① B. ②⑤ C. ④ D. ③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com