
【题目】有机化合物A(C8H8O2)为一种无色液体。从A出发可发生如图的一系列反应。则下列说法正确的是

A.A的结构中含有碳碳双键
B.G的同分异构体中属于酯且能发生银镜反应的只有一种
C.上述各物质中能发生水解反应的有A、B、D、G
D.根据图示可推知D为苯酚
【答案】D
【解析】
B能和二氧化碳、水反应生成D,D能和溴水发生取代反应生成白色沉淀,说明D中含有酚羟基,所以A中含有苯环,A的不饱和度是5,则A中还含有一个不饱和键,A能和氢氧化钠的水溶液发生水解反应生成B和C,则A中含有酯基,C酸化后生成E,E是羧酸,E和乙醇发生酯化反应生成G,G的分子式为C4H8O2,则E的结构简式为CH3COOH,C为CH3COONa,G的结构简式为CH3COOCH2CH3,结合A 的分子式可知,B为苯酚钠,D为苯酚,F为三溴苯酚,结构简式为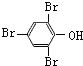 ,A为
,A为![]() 。
。
A、由上述分析可知,A为![]() ,结构中不含碳碳双键,故错误;
,结构中不含碳碳双键,故错误;
B、G的结构简式为CH3COOCH2CH3,它的同分异构体中属于酯且能发生银镜反应,应是甲酸形成的酯,相应的醇有1-丙醇,2-丙醇,有2种,B错误;
C、D为苯酚,不能发生水解反应,C错误;
D、由上述分析可知,D为苯酚,D正确。
答案选D。


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
【题目】平衡体系mA(g)+nB(g)![]() pC(g)+qD(g)有下列判断:①温度不变时,将容器体积增大一倍,若A的浓度变为原来的0.48倍,则m+n>p+q②若平衡时A和B的转化率相等,说明起始时A和B的物质的量之比为m:n③若改变一个条件使反应重新达到平衡时,D的浓度增大了,说明平衡向右移动了④若平衡体系中A、B、C、D的物质的量分别为a、b、c、dmol,则再向其中加入a、b、c、dmol的A、B、C、D时,平衡可能不移动⑤若平衡后降低温度,该反应的化学反应平衡常数增大,说明该反应的ΔH>0,其中正确的是( )
pC(g)+qD(g)有下列判断:①温度不变时,将容器体积增大一倍,若A的浓度变为原来的0.48倍,则m+n>p+q②若平衡时A和B的转化率相等,说明起始时A和B的物质的量之比为m:n③若改变一个条件使反应重新达到平衡时,D的浓度增大了,说明平衡向右移动了④若平衡体系中A、B、C、D的物质的量分别为a、b、c、dmol,则再向其中加入a、b、c、dmol的A、B、C、D时,平衡可能不移动⑤若平衡后降低温度,该反应的化学反应平衡常数增大,说明该反应的ΔH>0,其中正确的是( )
A.②④B.②③C.①④⑤D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20.00 mL的NaOH溶液中逐滴加入某浓度的CH3COOH溶液。滴定过程中,溶液的pH与滴入CH3COOH溶液的体积关系如图所示,点②时NaOH溶液恰好被中和。则下列说法中,错误的是

A.CH3COOH溶液的浓度为0.1 mol·L-1
B.图中点①到点③所示溶液中,水的电离程度先增大后减小
C.点④所示溶液中存在:(CH3COOH)+c(H+)=c(CH3COO-)+c(OH-)
D.滴定过程中会存在:c(Na+)> c(CH3COO-)=c(OH-)> c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温下浓度均为![]() 的下列5种溶液:
的下列5种溶液:![]() 溶液
溶液![]() 溶液
溶液![]() 溶液
溶液![]() 溶液
溶液![]() 溶液
溶液
![]() 这5种溶液pH由大到小的顺序是________________,其中由水电离的
这5种溶液pH由大到小的顺序是________________,其中由水电离的![]() 浓度最小的是______。
浓度最小的是______。![]() 填序号
填序号![]()
![]() 中各离子浓度由大到小的顺序是________________________________________________________,
中各离子浓度由大到小的顺序是________________________________________________________,![]() 的水解平衡常数
的水解平衡常数![]() _________________。
_________________。![]() 已知碳酸的电离常数
已知碳酸的电离常数![]() ,
,![]()
![]() 向
向![]() 中通入少量氨气,此时
中通入少量氨气,此时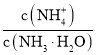 的值__________
的值__________![]() 填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变”![]() 。
。
![]() 若将
若将![]() 和
和![]() 混合后溶液恰好呈中性,则混合前
混合后溶液恰好呈中性,则混合前![]() 的体积______
的体积______![]() 的体积
的体积![]() 填“大于”、“小于”或“等于”
填“大于”、“小于”或“等于”![]() 。
。
![]() 将
将![]() 的溶液分别蒸干并灼烧,最终可得原溶质的是____________
的溶液分别蒸干并灼烧,最终可得原溶质的是____________![]() 填序号
填序号![]() 。
。
![]() 一定量的稀
一定量的稀![]() 溶液与足量的Zn反应,为减缓产生的
溶液与足量的Zn反应,为减缓产生的![]() 速率但又不影响
速率但又不影响![]() 的总量,可采取的措施是______
的总量,可采取的措施是______![]() 填字母
填字母![]() 。
。
A.加![]() 固体
固体![]() 加
加![]() 固体
固体![]() 加
加![]() 溶液
溶液![]() 加氨水
加氨水![]() 加
加![]() 溶液
溶液
![]() 常温下,向
常温下,向![]() 溶液中加入
溶液中加入![]() 溶液,可观察到的现象是_______________________________________,发生反应的离子方程式为______________________________,若将所得悬浊液的pH值调整为4,则溶液中
溶液,可观察到的现象是_______________________________________,发生反应的离子方程式为______________________________,若将所得悬浊液的pH值调整为4,则溶液中![]() 的溶液为_____
的溶液为_____![]()
![]() 已知常温下
已知常温下![]() 。
。
![]() 等体积、等浓度的氢氧化钠与醋酸混合后溶液呈 ____________ 性,溶液中
等体积、等浓度的氢氧化钠与醋酸混合后溶液呈 ____________ 性,溶液中![]() __________
__________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() ;
;![]() 的氢氧化钠与
的氢氧化钠与![]() 的醋酸等体积混合后溶液呈__________________性,溶液中
的醋酸等体积混合后溶液呈__________________性,溶液中![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() ;
;
![]() 常温下,用
常温下,用![]() 溶液滴定
溶液滴定![]() 某一元酸HA溶液所得滴定曲线如图.
某一元酸HA溶液所得滴定曲线如图.
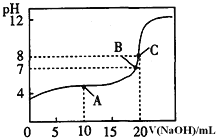
![]() A、B、C三点所示溶液导电能力最强的是 ______ 点对应的溶液;
A、B、C三点所示溶液导电能力最强的是 ______ 点对应的溶液;
![]() 点的离子浓度大小关系是 ________________________________ .
点的离子浓度大小关系是 ________________________________ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某公司开发了一种以甲醇为原料,以KOH为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月。其中B电极的电极材料为碳,如图是一个电化学过程的示意图。请填空:
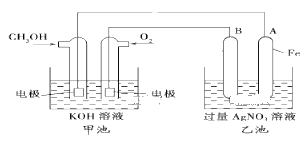
(1)充电时,原电池的负极与电源___极相连。乙池中阳极的电极反应为___。
(2)放电时:负极的电极反应式为___。
(3)在此过程中若完全反应,乙池中A极的质量增加648 g,则甲池中理论上消耗O2___L(标准状况下)。
(4)若在常温常压下,1gCH3OH燃烧生成CO2和液态H2O时放热22.68kJ,表示甲醇燃烧热的热化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种激光染料,应用于可调谐染料激光器,它由C、H、O三种元素组成,分子球棍模型如图所示,下列有关叙述正确的是

(1)分子式为C10H9O3(2)不能溶于水
(3)1mol该物质最多能与4molH2加成(4)能使酸性KMnO4溶液褪色
(5) 1mol该物质最多能与含2molNaOH的溶液反应.
A. (1)(2)(3)(4) B. (2)(4)(5)
C. (2)(3)(4) D. (1)(2)(3)(4)(5)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() 为卤代烃,X为卤族原子
为卤代烃,X为卤族原子![]() ,生成的卤代烃基镁与具有羰基结构的化合物
,生成的卤代烃基镁与具有羰基结构的化合物![]() 醛、酮等
醛、酮等![]() 发生反应,再水解就能合成各种指定结构的醇:
发生反应,再水解就能合成各种指定结构的醇:

现以![]() 丁烯和必要的无机物为原料合成
丁烯和必要的无机物为原料合成![]() 二甲基
二甲基![]() 己醇,进而合成一种分子式为
己醇,进而合成一种分子式为![]() 的具有六元环的物质J,合成线路如下:
的具有六元环的物质J,合成线路如下:![]() 的核磁共振氢谱有三组峰
的核磁共振氢谱有三组峰![]()
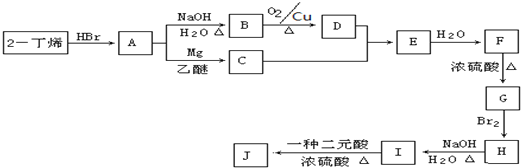
请按要求填空:
![]()
![]() 二甲基
二甲基![]() 己醇是: ___________
己醇是: ___________![]() 填代号
填代号![]() ,E的结构简式是 ___________
,E的结构简式是 ___________
![]() 的反应类型是 ___________,
的反应类型是 ___________,![]() 的反应类型是 ___________
的反应类型是 ___________
![]() 写出
写出![]() 化学反应方程式: ___________
化学反应方程式: ___________
![]() 的同分异构体共有 ___________种
的同分异构体共有 ___________种
![]() 为D的同分异构体且能发生银镜反应,写出所有M的结构简式 ___________;其中核磁共振氢谱中出现3组峰的物质与新制氢氧化铜悬浊液在煮沸条件下发生反应的方程式为: ___________.
为D的同分异构体且能发生银镜反应,写出所有M的结构简式 ___________;其中核磁共振氢谱中出现3组峰的物质与新制氢氧化铜悬浊液在煮沸条件下发生反应的方程式为: ___________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用Na2S沉淀Cu2+、Zn2+两种金属阳离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示。下列说法不正确的是( )

A.向Cu2+浓度为1×10-5mol·L-1的工业废水中加入ZnS粉末,会有CuS沉淀析出
B.25℃时,Ksp(CuS)约为1×10-35
C.向100mLZn2+、Cu2+浓度均为1×10-5 mol·L-1的混合溶液中逐滴加入1×10-4mol·L-1的Na2S溶液,Cu2+先沉淀
D.Na2S溶液中:c(H+)+c(HS-)+c(H2S)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】造成酸雨的主要物质是NO2和SO2,某科研小组进行如下研究。
(1)处理二氧化硫通常是先在水中把它氧化成硫酸,再用NH3H2O吸收。已知2NH3H2O(aq)+H2SO4(aq)=(NH4)2SO4(aq)+2H2O(l) ΔH=-24.2kJ/mol,中和热ΔH=-57.3kJ/mol则1molNH3H2O理论上完全电离时需要吸收的热量为___。
(2)常温下也可以用NaOH溶液直接吸收SO2,在吸收过程中,溶液pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-) | 88:12 | 1:1 | 12:88 |
pH | 8.2 | 7.4 | 6.0 |
①当吸收液呈中性时,溶液中离子浓度由大到小排列顺序为___。
②当向NaOH溶液中通入足量的SO2时,得到NaHSO3溶液,在pH为47之间电解,硫元素在阴极上被还原为Na2S2O4,这是电化学脱硫技术之一。写出该阴极的电极反应式___。
(3)向容积为2L,密闭容器中分别充入0.20molNO2和0.4molSO2,发生SO2(g)+NO2(g)SO3(g)+NO(g) ΔH=-41.8kJ/mol在不同温度下测定同一时刻NO2的转化率,结果如图所示。
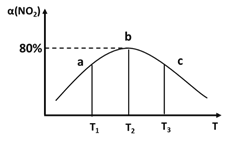
①a、c两点反应速率大小关系:v正(a)___v逆(c)。(填“>”“<”或“=”)
②温度为T2时,该反应的平衡常数为___。若在此温度下,保持容器的容积不变,再向容器中充入0.10molNO2和0.2molSO2,NO2的转化率___(填“增大”“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com