
【题目】25℃时,向20.00 mL的NaOH溶液中逐滴加入某浓度的CH3COOH溶液。滴定过程中,溶液的pH与滴入CH3COOH溶液的体积关系如图所示,点②时NaOH溶液恰好被中和。则下列说法中,错误的是

A.CH3COOH溶液的浓度为0.1 mol·L-1
B.图中点①到点③所示溶液中,水的电离程度先增大后减小
C.点④所示溶液中存在:(CH3COOH)+c(H+)=c(CH3COO-)+c(OH-)
D.滴定过程中会存在:c(Na+)> c(CH3COO-)=c(OH-)> c(H+)
【答案】C
【解析】
A、图象可知氢氧化钠溶液浓度为0.1mol/L,②点时NaOH溶液恰好被中和消耗醋酸溶液20mL,根据酸碱中和规律,醋酸的浓度为0.1mol/L,故A正确;
B、图中点①到点②所示溶液中随着醋酸逐渐滴入,氢氧化钠不断被消耗,水的电离被抑制程度逐渐减小,即水的电离程度增大;②恰好反应点,水的电离程度最大,从此以后继续滴加醋酸,对水电离起到抑制作用,所以图中点①到点③所示溶液中,水的电离程度先增大后减小,故B正确;
C、点④所示溶液是醋酸和醋酸钠溶液,c(CH3COOH)+c(CH3COO-)=2c(Na+),电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-),故C错误;
D、滴定过程中的某点,醋酸钠和氢氧化钠混合溶液中会有c(Na+)>c(CH3COO-)=c(OH-)>c(H+),故D正确;
故选C。


 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:
【题目】H2O2(l)在有MnO2条件下和无MnO2条件下分解的能量变化如图所示。下列说法正确是

A. 有MnO2条件下的反应曲线是a曲线
B. a曲线变为b曲线,反应的活化分子百分数增大
C. a曲线变为b曲线,平衡时H2O2的转化率增大
D. b曲线的热化学方程式为:H2O2(l) =H2O(l) +1/2O2(g) ΔH= - ( E1 - E2)KJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种高效氧化剂,可用来氧化吸附有机异味物,也可以与水中的杂质如二价铁、锰、硫、氰、酚等反应.实验室常用
是一种高效氧化剂,可用来氧化吸附有机异味物,也可以与水中的杂质如二价铁、锰、硫、氰、酚等反应.实验室常用![]() 标准溶液标定未知浓度的
标准溶液标定未知浓度的![]() 溶液,发生反应
溶液,发生反应![]() ↑.
↑.
根据以上信息,完成下列问题:
(1)按电子排布K位于元素周期表的________区,基态![]() 的核外电子排布式可表示为________.
的核外电子排布式可表示为________.
(2)![]() 中所含有的共价键数目为________.
中所含有的共价键数目为________.
(3)基态C原子的核外电子中占据最高能级的电子云轮廓图为________,![]() 中碳原子的轨道杂化类型是________.
中碳原子的轨道杂化类型是________.
(4)同主族元素氧、硫、硒对应最简单氢化物的沸点:![]() ,原因是________.
,原因是________.
(5)![]() 的结构中Se为面心立方最密堆积,晶胞结构如图所示.
的结构中Se为面心立方最密堆积,晶胞结构如图所示.
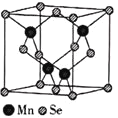
![]() 中Mn的配位数为________.
中Mn的配位数为________.
![]() 若该晶体的晶胞参数为apm,阿伏加德罗常数的值为
若该晶体的晶胞参数为apm,阿伏加德罗常数的值为![]() 则距离最近的两个锰原子之间的距离为________pm,
则距离最近的两个锰原子之间的距离为________pm,![]() 的密度
的密度![]() ________
________![]() 列出表达式
列出表达式![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用![]() 的
的![]() 溶液滴定
溶液滴定![]()
![]() 的
的![]() 溶液,水的电离程度随
溶液,水的电离程度随![]() 溶液体积的变化曲线如图所示。下列说法正确的是( )
溶液体积的变化曲线如图所示。下列说法正确的是( )

A.该滴定过程应该选择甲基橙作为指示剂
B.从![]() 点到
点到![]() 点,溶液中水的电离程度逐渐增大
点,溶液中水的电离程度逐渐增大
C.![]() 点溶液中
点溶液中![]()
D.![]() 点对应的
点对应的![]() 溶液的体积为
溶液的体积为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、根据氧化还原反应:2Ag+(aq)+ Cu(s) = Cu2+(aq)+ 2Ag(s) 设计的原电池如下图所示,其中盐桥为琼脂–饱和KNO3盐桥。请回答下列问题:
(1)电极X的材料是 ___________;电解质溶液Y是 ____________________。
(2)银电极为电池的 __________ 极,其电极反应式为:___________________________________ 。
(3)盐桥中向CuSO4溶液中迁移的离子是 ___________。

A、K+ B、NO3― C、Ag+ D、SO42―
Ⅱ、酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉、MnO2、ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料。回答下列问题:
(1)该电池的正极反应式为 ________________________,电池反应的离子方程式为________________________________________
(2)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过 ___________________________________ 分离回收。
(3)滤渣的主要成分是MnO2、碳粉和MnOOH,欲从中得到较纯的MnO2,最简便的方法是_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向一定浓度的Na2X溶液中滴入盐酸,溶液的pH与离子浓度变化关系如图所示。

已知:H2X是二元弱酸,Y表示![]() 或
或![]() ,pY=﹣lgY.下列叙述不正确的是( )
,pY=﹣lgY.下列叙述不正确的是( )
A. 曲线n表示pH与p![]() 的变化关系
的变化关系
B. Ka2(H2X)=1.0×10﹣10.3
C. NaHX溶液中c(H+)>c(OH﹣)
D. 当溶液呈中性时,c(Na+)=c(HX﹣)+2c(X2﹣)+c(Cl﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,往一定浓度的醋酸溶液中加入NaOH溶液,所得溶液![]() 表示
表示![]() 或
或![]() ,pX表示对应微粒物质的量浓度的负对数
,pX表示对应微粒物质的量浓度的负对数![]() 与pH的关系如图所示。下列说法错误的是
与pH的关系如图所示。下列说法错误的是![]()

A.曲线A代表![]() 表示
表示![]() 与pH的关系
与pH的关系
B.常温下,![]() 的数量级为
的数量级为![]()
C.水的电离程度:![]()
D.Y点对应溶液为等物质的量浓度的![]() 和
和![]() 的混合溶液
的混合溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物A(C8H8O2)为一种无色液体。从A出发可发生如图的一系列反应。则下列说法正确的是

A.A的结构中含有碳碳双键
B.G的同分异构体中属于酯且能发生银镜反应的只有一种
C.上述各物质中能发生水解反应的有A、B、D、G
D.根据图示可推知D为苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】G是一种治疗急慢性呼吸道感染的特效药中间体,其制备路线如图:

(1)化合物C中的含氧官能团是_____。
(2)A→B的反应类型是______。
(3)化合物F的分子式为C14H21NO3,写出F的结构简式______。
(4)从整个制备路线可知,反应B→C的目的是______。
(5)同时满足下列条件的B的同分异构体共有_______种。
①分子中含有苯环,能与NaHCO3溶液反应;
②能使FeCl3溶液显紫色
(6)根据已有知识并结合相关信息,完成以![]() 、CH3NO2为原料制备
、CH3NO2为原料制备 的合成路线图____(无机试剂任用,合成路线流程图示例见本题题干)。
的合成路线图____(无机试剂任用,合成路线流程图示例见本题题干)。
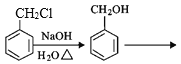
 ,其中第二步反应的方程式为_____。
,其中第二步反应的方程式为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com