
【题目】某学习小组探究铁和硝酸银溶液的反应,实验过程如下:
实验序号 | 实验操作 | 实验现象 |
I | 将一束光亮洁净的铁丝伸入到0.1mol/L 的AgNO3溶液中 | 铁丝表面有银白色固体析出,溶液逐渐变为浅绿色 |
II | 取少量实验I中上层清液,滴入K3[Fe(CN) 6]溶液 | 有蓝色沉淀生成 |
(1)根据上述实验现象,甲同学认为有Fe2+生成,铁和硝酸银溶液的反应的离子方程式是____________________。
(2)乙同学认为实验中可能生成Fe3+,设计并完成如下实验
实验序号 | 实验操作 | 实验现象 |
III | 取少量实验I中上层清液,滴入少量KSCN溶液,振荡 | 产生白色沉淀,溶液局部变红,振荡后红色消失,沉淀量增加 |
查阅资料:Ag+与SCN-生成白色沉淀AgSCN
乙同学判断有Fe3+,理由是 ____________________。
(3)乙同学继续探究红色褪去的原因,设计并完成如下实验
实验序号 | 实验操作 | 实验现象 |
IV | 取少量实验I中上层清液,滴加几滴稀盐酸 | 有白色沉淀生成 |
V | 取1mLFe(NO3)3溶液,滴加2滴等浓度的KSCN溶液,振荡,再滴加少量AgNO3溶液 | 溶液变红;振荡溶液颜色无变化,滴加AgNO3后溶液红色褪去,产生白色沉淀. |
① 实验IV的目的是____________________;
② 用平衡移动原理解释,实验V中溶液红色褪去的原因____________________。
(4)丙认为溶液中Fe3+是Fe2+被Ag+氧化所致。按下图连接装置并进行实验,一段时间后取出左侧烧杯溶液加入KSCN溶液,溶液变红
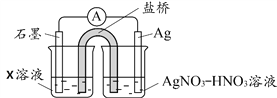
① 其中X溶液是____________________;
② 由实验得出Ag+和Fe2+反应的离子方程式是____________________;
③ 丙同学的实验设计及结论是否合理,请说明理由____________________。
【答案】 2Ag++Fe==== Fe2++2Ag 溶液局部变红 证明实验I上层清液中存在Ag+ Fe3++3SCN-![]() Fe(SCN)3,加入硝酸银后,Ag+与SCN-生成白色沉淀AgSCN,SCN-浓度降低促使平衡逆向移动红色褪去。 Fe(NO3)2 ( aq) Ag++Fe2+====Ag+Fe3+ 不合理,有可能空气中的氧气将Fe2+氧化为Fe3+
Fe(SCN)3,加入硝酸银后,Ag+与SCN-生成白色沉淀AgSCN,SCN-浓度降低促使平衡逆向移动红色褪去。 Fe(NO3)2 ( aq) Ag++Fe2+====Ag+Fe3+ 不合理,有可能空气中的氧气将Fe2+氧化为Fe3+
【解析】(1)铁和硝酸银溶液的反应生成硝酸亚铁和银,反应的离子方程式是2Ag++Fe==== Fe2++2Ag;(2)取少量实验I中上层清液,滴入少量KSCN溶液,振荡,溶液局部变红,故此乙同学判断有Fe3+;(3)① 实验IV的目的是证明实验I上层清液中存在Ag+;②Fe3++3SCN-![]() Fe(SCN)3,加入硝酸银后,Ag+与SCN-生成白色沉淀AgSCN,SCN-浓度降低促使平衡逆向移动红色褪去;(4)①溶液中Fe3+是Fe2+被Ag+氧化所致,右边溶液含有银离子,左边溶液应该含有亚铁离子,故X溶液是Fe(NO3)2溶液;② 由实验得出Ag+和Fe2+反应生成Fe3+和Ag,反应的离子方程式是Ag++Fe2+=Ag+Fe3+;③有可能空气中的氧气将Fe2+氧化为Fe3+,故丙同学的实验设计及结论不合理。
Fe(SCN)3,加入硝酸银后,Ag+与SCN-生成白色沉淀AgSCN,SCN-浓度降低促使平衡逆向移动红色褪去;(4)①溶液中Fe3+是Fe2+被Ag+氧化所致,右边溶液含有银离子,左边溶液应该含有亚铁离子,故X溶液是Fe(NO3)2溶液;② 由实验得出Ag+和Fe2+反应生成Fe3+和Ag,反应的离子方程式是Ag++Fe2+=Ag+Fe3+;③有可能空气中的氧气将Fe2+氧化为Fe3+,故丙同学的实验设计及结论不合理。


科目:高中化学 来源: 题型:
【题目】某化学兴趣小组要完成中和热的测定实验.
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、量筒、稀盐酸(0.5molL﹣1)、稀 NaOH溶液(0.55molL﹣1),尚缺少的实验玻璃用品是、 .
(2)写出表示稀盐酸和稀氢氧化钠溶液反应中和热的热化学方程式(中和热为57.3kJmol﹣1): .
(3)若用稀醋酸、稀硫酸、浓硫酸分别和稀氢氧化钠溶液反应来测定中和热,恰好完全反应时对应的热效应分别为△H1、△H2、△H3的大小关系是 .
(4)每组实验所用氢氧化钠溶液和稀盐酸的体积均为 50mL,可近似认为该实验中稀盐酸和稀氢氧化钠溶液的密度均为 1g/cm3,中和后生成溶液的比热容c=4.18J/(g℃),实验中记录数据如表所示,请填写表中空白:
编号 | 起始温度T1/℃ | 终止温度T2/℃ | 平均温度差T2﹣T1/℃ | △H | ||
盐酸 | NaOH | 平均值 | ||||
① | 26.2 | 26.0 | 26.1 | 29.2 |
|
|
② | 25.9 | 25.9 | 25.9 | 29.2 | ||
③ | 26.4 | 26.2 | 26.3 | 29.5 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烯烃A在一定条件下可以按下面的框图进行反应. 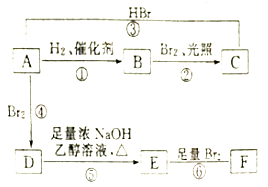
已知:D是 
请填空:
(1)A的结构简式是 .
(2)框图中属于取代反应的是消去反应(填数字代号).
(3)框图中①、③、⑥属于反应.
(4)C的结构简式是 .
(5)写出由D→E的化学方程式;写出由E→F的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和NO都是汽车尾气中的有害物质,它们之间能缓慢地发生如下反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) ΔH<0,现利用此反应,拟设计一种环保装置,用来消除汽车尾气对大气的污染,下列设计方案可以最有效的提高尾气处理效果的是 ( )
N2(g)+2CO2(g) ΔH<0,现利用此反应,拟设计一种环保装置,用来消除汽车尾气对大气的污染,下列设计方案可以最有效的提高尾气处理效果的是 ( )
①选用适当的催化剂 ②提高装置温度 ③降低装置的压强 ④装置中放入碱石灰
A. ①④ B. ②④ C. ① D. ②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛铁矿主要成分为FeTiO3(含有少量MgO、SiO2等杂质),Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿来制备,工艺流程如下:

(1)钛铁矿在预处理时需要进行粉碎,其原因是___________________。
(2)过程①中反应的离子方程式是: FeTiO3 + 4H++ 4Cl-== Fe2+ + TiOCl42-+ 2H2O、_______。
(3)过程①中,铁的浸出率结果如图1所示。由图可知,当铁的浸出率为80%时,所采用的实验条件是___________________。

(4)过程②中固体TiO2与双氧水、氨水反应转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如图2所示,反应温度过高时,Ti元素浸出率下降的原因是___________。
(5)在滤液B转化为FePO4沉淀过程中发生以下反应,请配平:
Fe2+ +_____ + H3PO4 ===FePO4 + ____ + _____
(6)过程③中由FePO4制备LiFePO4的化学方程式是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验装置进行相应的实验,不能达到实验目的的是

A. 利用图甲装置,可快速制取氨气
B. 利用图乙装置,用饱和碳酸钠溶液分离CH3CH2OH和CH3COOC2H5混合液
C. 利用图丙,可验证增加反应物浓度对化学平衡的影响
D. 利用图丁装置,可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性,还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铵明矾[NH4Al(SO4)2·12H2O]是分析化学常用的基准试剂,工业上常用铝土矿(主要成分为Al2O3)来生产铵明矾,其中Z的水溶液可用于伤口消毒,其工艺流程图如下:
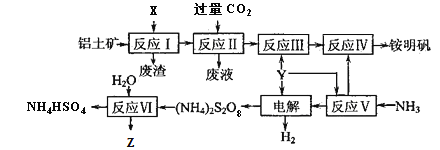
(1)写出反应Ⅱ的离子方程式____________________。
(2)25℃时,将0.2 mol·L-1的氨水与0.1 mol·L-1的Y溶液等体积混合,所得溶液的pH=5,则该温度下氨水的电离常数Kb≈_____________(忽略混合时溶液体积的变化)。
(3)从反应Ⅳ的铵明矾溶液中获得铵明矾晶体的实验操作依次为_____________、____________、过滤、洗涤(填操作名称)。
(4)“电解”时,用惰性材料作电极,则阳极电极反应式为__________________________。
(5)反应Ⅵ的化学方程式为______________________。
(6)废水中含有Fe2+、Mn2+等金属离子对自然环境有严重的破坏作用,,可用(NH4)2S2O8氧化除去。写出Mn2+被氧化生成MnO2的离子方程式为__________________________________。Z也有较强氧化性,在实际生产中不用Z氧化Mn2+的原因是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 实验室采用如图所示装置制备乙酸乙酯,实验结束后,取下盛有饱和碳酸钠溶液的试管,再沿该试管内壁缓缓加入紫色石蕊试液1毫升,发现紫色石蕊试液存在于饱和碳酸钠溶液层与乙酸乙酯液层之间(整个过程不振荡试管),下列有关该实验的描述,不正确的是( )

A.制备的乙酸乙酯中混有乙酸和乙醇杂质
B.该实验中浓硫酸的作用是催化和吸水
C.饱和碳酸钠溶液主要作用是降低乙酸乙酯的溶解度及吸收乙醇、中和乙酸
D.石蕊层为三层环,由上而下是蓝、紫、红
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com