
【题目】根据如图能量关系示意图,下列说法正确的是( )

A.1molC(s)与1 molO2(g)的能量之和为393.5kJ
B.反应2CO(g)+O2(g)=2CO2(g)中,生成物的总能量大于反应物的总能量
C.由C(s)→CO(g)的热化学方程式为:2C(s)+O2(g)= 2CO(g) ΔH=-221.2kJ·mol-1
D.CO的燃烧热ΔH=-282.9kJ
【答案】C
【解析】
A. 1molC(s)与1 molO2(g)反应变成1mol二氧化碳气体,放出的能量为393.5kJ ,不能说明碳和氧气的能量和就是393.5kJ,故错误;
B. 反应2CO(g)+O2(g)=2CO2(g)为放热反应,故生成物的总能量小于反应物的总能量,故错误;
C. 根据图示可以分析,有①C(s)+O2(g)= CO2 (g) ΔH=-393.5kJ·mol-1, ②CO(g)+![]() O2(g)= CO2(g) ΔH=-282.9kJ·mol-1,故根据盖斯定律分析,①-②得C(s)→CO(g)的热化学方程式C(s)+
O2(g)= CO2(g) ΔH=-282.9kJ·mol-1,故根据盖斯定律分析,①-②得C(s)→CO(g)的热化学方程式C(s)+![]() O2(g)= CO(g) ΔH=-393.5+282.9=-110.6kJ·mol-1,可写成2C(s)+O2(g)= 2CO(g) ΔH=-221.2kJ·mol-1,故正确;
O2(g)= CO(g) ΔH=-393.5+282.9=-110.6kJ·mol-1,可写成2C(s)+O2(g)= 2CO(g) ΔH=-221.2kJ·mol-1,故正确;
D.燃烧热的单位为kJ·mol-1,故错误。
故选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),向20mL0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液,根据图示判断,下列说法正确的是( )
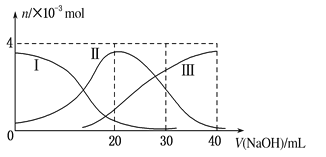
A.H2A在水中的电离方程式是:H2A=H++HA-;HA-![]() H++A2-
H++A2-
B.当V(NaOH)=20 mL时,溶液中各离子浓度的大小顺序为:c(OH-) >c(H+)
C.当V(NaOH)=40 mL时,溶液中水的电离程度比纯水大
D.当V(NaOH)=30 mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)=c(A2-)+2c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。
(1)把与下面元素有关性质相符的曲线标号填入相应的空格中:
a.  b.
b.  c.
c.  d.
d. 
①第ⅡA族元素的价电子数________。
②第三周期元素的最高化合价________。
③F-、Na+、Mg2+、Al3+的离子半径________。
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M元素原子的最外层电子数与电子层数之比为4∶3;N-、Z+、X+的半径逐渐减小;化合物XN常温下为气体。据此回答:
①X为___________(名称),Y为____________(元素符号),Z原子结构示意图为________________。
②N的最高价氧化物的水化物的化学式为________________。
③M的最高价氧化物的化学式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)在纤维纺织品的染色和漂白、照相、生产橡胶、制药等领域有广泛应用,也常用于鱼类、肉类等食品的染色和防腐。但因其有毒,所以在食品行业中的用量有严格限制。现用下图所示仪器(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物的成分。
已知:①NO+NO2+2OH-===2NO2-+H2O;
②气体液化的温度:NO2为21 ℃,NO为-152 ℃。
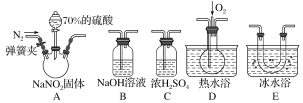
(1)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接)为A、C、________、________、________。
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,目的是________________________________________________________________________。
(3)在关闭弹簧夹、打开分液漏斗活塞、滴入70%硫酸后,A中产生红棕色气体。
①确认A中产生的气体含有NO,依据的现象是________________________。
②装置E的作用是_________________________________________________。
(4)如果向D中通入过量O2,则装置B中发生反应的化学方程式为___________。
(5)通过上述实验探究过程,可得出装置A中反应的化学方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀。(此转化关系中所用的试剂都是足量的)
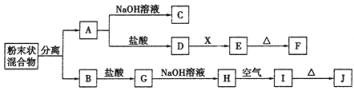
(1)写出下列物质的化学式:F____________,G________________。
(2)将混合物中两种金属分离开的最简单的方法是___________。
(3)D→E的转化中,加入过量的X可能是_____________________。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:
A→C:______________________________________________;
H→I:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2 L的密闭容器中通入两种气体,发生化学反应生成另外两种气体,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是
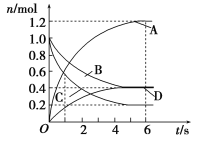
A. 该反应的化学方程式为3B(g)+4D(g)![]() 6A(g)+2C(g)
6A(g)+2C(g)
B. 反应进行到1 s时,v(A)=v(D)
C. 反应进行到6 s时,B的平均反应速率为0.05 mol/(L·s)
D. 反应进行到6 s时,各物质的反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的F2和ClF混合,在密闭容器中发生反应:F2(g)+ClF(g)![]() ClF3(g) ΔH<0。下列叙述正确的是
ClF3(g) ΔH<0。下列叙述正确的是
A.保持恒容,平衡后再降低温度,平衡常数减小
B.若增加F2的用量,平衡正向移动,则反应物的转化率均增大
C.达到平衡后,若增大容器体积,则正反应速率减小,逆反应速率增大,平衡左移
D.恒温恒容时,当ClF转化40%时,容器内的压强为初始时的0.8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于四种基本反应类型,但属于氧化还原反应的是( )
A. Fe + CuSO4 = FeSO4+ Cu
B. AgNO3+ NaCl= AgCl↓ + NaNO3
C. MnO2 + 4 HCl(浓) ![]() MnCl2+ Cl2↑ + 2 H2O
MnCl2+ Cl2↑ + 2 H2O
D. 2KMnO4 ![]() K2MnO4 + MnO2 + O2↑
K2MnO4 + MnO2 + O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国不少古诗词清晰描述了当时人们的生活和社会的发展,如刘禹锡的《浪淘沙》“日照澄洲江雾开,淘金女伴满江隈,美人首饰侯王印,尽是沙中浪底来。”下列有关本诗中蕴含的化学知识认知正确的是
A.雾的分散质粒子直径范围是1~100nmB.淘金原理与化学上的萃取一致
C.沙子的主要成分是![]() D.“沙中浪底来”指的是金的氧化物
D.“沙中浪底来”指的是金的氧化物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com