
【题目】(1)25 ℃时,0.1 mol·L-1NaOH溶液的pH为________;
(2)25 ℃时,0.1 mol·L-1NH4Cl溶液的pH________7(填“<”、“=”或“>”),其原因是__________________(用离子方程式表示);
(3)将上述两种溶液等体积混合后,离子浓度大小次序正确的是________(填序号)。
A.[Na+]>[Cl-]>[OH-]>[H+] |
B.[Na+]=[Cl-]>[H+]>[OH-] |
C.[Na+]=[Cl-]>[OH-]>[H+] |
D.[Cl-]>[Na+]>[OH-]>[H+] |
(4)25 ℃时,0.1 mol·L-1NaOH溶液中水电离出来的氢氧根的浓度为C1,0.1 mol·L-1NH4Cl溶液中水电离出来的氢离子的浓度为C2,则C1______C2(填“<”、“=”或“>”)
【答案】13 < NH4++H2O![]() NH3·H2O+H+ C <
NH3·H2O+H+ C <
【解析】
(1)0.1mol·L-1NaOH溶液的c(OH-)= mol·L-1, ![]() mol·L-1,所以pH=-lgc(H+)=-lg10-13=13,
mol·L-1,所以pH=-lgc(H+)=-lg10-13=13,
因此,本题正确答案是:13;
(2)因为发生NH4++H2O![]() NH3·H2O+H+,NH4+能结合水电离出来的OH-生成弱电解质NH3·H2O,破坏了水的电离平衡,使溶液显酸性,
NH3·H2O+H+,NH4+能结合水电离出来的OH-生成弱电解质NH3·H2O,破坏了水的电离平衡,使溶液显酸性,
因此,本题正确答案是:<;NH4++H2O![]() NH3·H2O+H+;
NH3·H2O+H+;
(3)将两种溶液等体积混合,发生反应:NaOH+NH4Cl═NaCl+ NH3·H2O,Na+和Cl-均不水解,故浓度相等,NH3·H2O能电离出OH-,电离极其微弱,使c(OH-)>c(H+),所以离子浓度关系为:c(Na+)=c(Cl-)>c(OH-)>c(H+),所以C选项是正确的。
(4)25 ℃时,0.1 mol·L-1NaOH溶液中水电离出来的氢氧根的浓度为C1=10-13mol/L;0.1 mol·L-1NH4Cl溶液中水电离出来的氢离子的浓度为C2=10-1mol/L,,则C1<C2。
因此,本题正确答案是:<。


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】由短周期元素组成的中学常见的含钠元素的物质A、B、C、D,存在如图转化关系(部分生成物和反应条件已略去)。

(1)若A为过氧化钠,A与CO2反应的化学方程式为___,A与水反应的离子方程式为___。
(2)①向饱和C溶液中通CO2,化学方程式为:___。
②1mol/L的B溶液逐滴加入1L1mol/L的AlCl3溶液中,产生白色沉淀39g,则所加入的B溶液的体积可能为___L。
(3)下列图象中,横坐标表示加入试剂或通入气体的物质的量,纵坐标表示产生沉淀的质量,用图象的序号或文字回答下列问题:

Ⅰ.表示向AlCl3溶液中逐渐滴加NaOH溶液的是___;
Ⅱ.表示向NaAlO2溶液中逐渐滴加稀盐酸的是___;
Ⅲ.表示向NaAlO2溶液中通入CO2的是___;
Ⅳ.③图___(填“能”或“不能”)代表向含NaOH的澄清石灰水中通入CO2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t ℃时,某平衡体系中含有X、Y、Z、W四种物质,此温度下发生反应的平衡常数表达式为K=![]() 。有关该平衡体系的说法正确的是
。有关该平衡体系的说法正确的是
A. 当混合气体的平均相对分子质量保持不变时,反应达平衡
B. 增大压强,各物质的浓度不变
C. 升高温度,平衡常数K增大
D. 增加X的量,平衡既可能正向移动,也可能逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是( )


A. ①是其他条件一定时,反应速率随温度变化的图像,正反应ΔH<0
B. ②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图像
C. ③是在有无催化剂存在下建立的平衡过程图像,a是使用催化剂时的曲线
D. ④是一定条件下,向含有一定量A的容器中逐渐加入B时的图像,压强p1>p2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是我国科学家研制的一种新型化学电池,成功实现了废气的处理和能源的利用(H2R和R都是有机物)。下列说法不正确的是( )
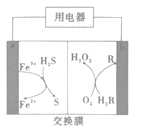
A.电池工作时,电子从电极b流出
B.负极区,发生反应2Fe3++H2S=2Fe2++S+2H+
C.电池工作时,负极区要保持呈酸性
D.电路中每通过2mol电子,理论上可处理标准状况下H2S22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式书写错误的是( )
A.NaHCO3水解的离子方程式:HCO3-+ H2O![]() CO32-+H3O+
CO32-+H3O+
B.NH4Cl水解的化学方程式:NH4Cl+H2O![]() NH3·H2O+HCl
NH3·H2O+HCl
C.Al(OH)3的两性电离方程式:H++AlO2-+H2O![]() Al(OH)3
Al(OH)3![]() Al3++3OH
Al3++3OH
D.NaHSO3的电离方程式:NaHSO3=Na++HSO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式不正确的是
A. 小苏打溶液呈弱碱性:HCO3-+H2O![]() CO32-+H3O+
CO32-+H3O+
B. 测0.1mol/L氨水的pH为11:NH3·H2O![]() NH4++OH-
NH4++OH-
C. pH=5的硫酸稀释1000倍,pH约等于7:H2O![]() H++OH-
H++OH-
D. 用Na2CO3处理水垢中CaSO4:CaSO4(s)+CO32-(aq)![]() SO42-(aq)+CaCO3(s)
SO42-(aq)+CaCO3(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】活性炭可处理大气污染物NO。T℃时,在1L密闭容器中加入NO气体和炭粉,发生反应生成两种气体A和B,测得各物质的物质的量如下:
活性炭/mol | NO/mol | A/mol | B/mol | |
起始状态 | 2.030 | 0.100 | 0 | 0 |
2 min时 | 2.000 | 0.040 | 0.030 | 0.030 |
(1)2 min内,用NO表示该反应的平均速率v(NO)=______mol·L-1·min-1。
(2)该反应的化学方程式是______;T℃时,它的平衡常数K=9/16,则2 min时反应______(填“是”或“不是”)平衡状态;已知升高温度时,K增大,则该反应为______(填“吸热”或“放热”)反应。
(3)为了提高反应速率和NO的转化率,可采取的措施是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合元素周期表回答下列问题:
(1)表中的实线是元素周期表的部分边界,请在图中用实线补全元素周期表的边界______。
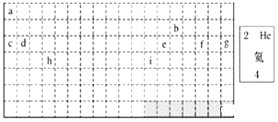
(2)表中所列元素,属于短周期元素的有______(用元素符号回答),属于主族元素的有______(用元素符号回答)。
(3)g元素位于第______周期第______族;i元素位于第______周期第______族。
(4)元素f是第______周期第______族元素,请按氦元素的式样写出该元素的原子序数、元素符号、元素名称、相对原子质量_________。
(5)写出b元素的基态原子的电子排布式______,写出h元素的符号______,该原子的价层电子排布图______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com