
【题目】已知可逆反应:M(g)+N(g)![]() P(g)+Q(g) △H>0;请回答下列问题:
P(g)+Q(g) △H>0;请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(M)=1mol·L-1,c(N)=2.4mol·L-1,达到平衡后,M的转化率为60%,此时N的转化率为___;
(2)若反应温度升高,M的转化率__(填“增大”“减小”或“不变”);
(3)若反应温度不变,反应物的起始浓度分别为:c(M)=4mol·L-1,c(N)=amol·L-1;达到平衡后,c(P)=2mol·L-1,a=__。
【答案】25% 增大 6
【解析】
(1)、根据M的转化率为60%计算出M的浓度变化量,利用浓度变化量之比等于化学计量数之比求出N的浓度变化量,再根据转化率定义计算;
(2)、该反应正反应为吸热反应,升高温度平衡向吸热方向移动,即向正反应方向移动,M的转化率增大;
(3)、由于温度不变,则平衡常数不变,与(1)相同,利用三段式计算平衡时各组分的浓度,代入平衡常数计算。
(1)、△c(M)=60%×1mol/L=0.6mol/L,浓度变化量之比等于化学计量数之比,所以△c(N)=△c (M)= 0.6mol/L,故此时N的转化率![]() ;
;
故答案为:25%;
(2)、该反应正反应为吸热反应,升高温度平衡向吸热方向移动,即向正反应方向移动,M的转化率增大,故答案为:增大;
(3)、△c(M)= 60%×1mol/L= 0.6mol/L,
则: M(g)+ N(g) ![]() P(g)+ Q(g);
P(g)+ Q(g);
初始(mol/L): 1 2.4 0 0
转化(mol/L): 0.6 0.6 0.6 0.6
平衡(mol/L): 0.4 1.8 0.6 0.6
故该温度下平衡常数![]() ,
,
反应温度不变,反应物的起始浓度分别为c(M)=4 mol/L,c(N)=a mol/L;达到平衡后,c(P)= 2mol/L;
则: M(g)+ N(g)= P(g)+ Q(g);
初始(mol/L): 4 a 0 0
转化(mol/L): 2 2 2 2
平衡(mol/L): 2 a-2 2 2
![]() ,解得a=6;
,解得a=6;
故答案为:6。


科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.锅炉水垢中的![]() 经饱和碳酸钠溶液浸泡可转化为
经饱和碳酸钠溶液浸泡可转化为![]()
B.常温下,在含有![]() 和
和![]() 的溶液中,
的溶液中,![]() 和
和![]() 浓度之积是个常数
浓度之积是个常数
C.当醋酸达到电离平衡后,改变某条件电离平衡向正反应方向移动,则溶液的导电能力一定变强
D.将浓度为![]()
![]() 的HF溶液加水不断稀释,溶液
的HF溶液加水不断稀释,溶液![]() 始终保持增大
始终保持增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以氯酸钠(NaClO3)等为原料制备亚氯酸钠(NaClO2)的工艺流程如下,下列说法中,不正确的是
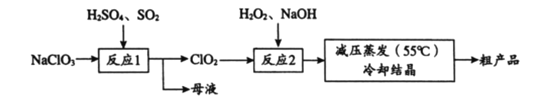
A. 反应1中,每生成1 mol ClO2有0.5 mol SO2被氧化
B. 从母液中可以提取Na2SO4
C. 反应2中,H2O2做氧化剂
D. 采用减压蒸发可能是为了防止NaClO2受热分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2SO2(g)+O2(g)![]() 2SO3(g)△H<0,在一定条件下达到平衡状态,时间为t1时改变条件.化学反应速率与反应时间的关系如图所示.下列说法正确的是( )
2SO3(g)△H<0,在一定条件下达到平衡状态,时间为t1时改变条件.化学反应速率与反应时间的关系如图所示.下列说法正确的是( )

A. 维持温度、容积不变,t1时充入SO3(g)
B. 维持压强不变,t1时升高反应体系温度
C. 维持温度、容积不变,t1时充入一定量Ar
D. 维持温度、压强不变,t1时充入SO3(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学科研小组在其他条件不变时,改变某一条件对反应[可用aA(g)+bB(g)![]() cC(g)表示]的化学平衡的影响,得到如图图象(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率)。根据图象,下列判断正确的是( )
cC(g)表示]的化学平衡的影响,得到如图图象(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率)。根据图象,下列判断正确的是( )
A. 如图反应:若p1>p2,则此反应只能在高温下自发进行
如图反应:若p1>p2,则此反应只能在高温下自发进行
B. 如图反应:此反应的△H<0,且T1<T2
如图反应:此反应的△H<0,且T1<T2
C. 如图反应:表示t1时刻一定是使用催化剂对反应速率的影响
如图反应:表示t1时刻一定是使用催化剂对反应速率的影响
D. 如图反应:表示t1时刻增大B的浓度对反应速率的影响
如图反应:表示t1时刻增大B的浓度对反应速率的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: 25℃、101 kPa下:① 2 Na(s) + 1/2 O2(g) = Na2O(s) △H1 = - 414 kJ / mol
② 2 Na(s) + O2(g) = Na2O2(s) △H2 = - 511 kJ / mol
下列说法正确的是
A. ①和②产物的阴阳离子个数比不相等
B. ①和②生成等物质的量的产物,转移电子数不同
C. 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D. 25℃、101 kPa下,Na2O2(s) + 2 Na(s) = 2 Na2O(s) △H = -317 kJ / mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的X、Y气体充入一个密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+Y(g) ![]() 2Z(g) H<0。当改变某个条件并达到新平衡后,下列叙述不正确的是( )
2Z(g) H<0。当改变某个条件并达到新平衡后,下列叙述不正确的是( )
A.升高温度;X的体积分数增大
B.增大压强(缩小容器体积),Z的物质的量不变
C.保持容器体积不变,充入稀有气体,Y的浓度不变
D.保持容器体积不变,充入一定量的Z,X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化钠是一种重要的化工原料。工业上用硫酸钠来制得硫化钠。制备硫化钠的反应原理为: Na2SO4(s)+4H2(g) ![]() Na2S(s)+4H2O(g) △H>0,已知该可逆反应在1000°C时达到平衡,并保持反应器内恒温恒容。试回答下列问题:
Na2S(s)+4H2O(g) △H>0,已知该可逆反应在1000°C时达到平衡,并保持反应器内恒温恒容。试回答下列问题:
(1)此可逆反应的平衡常数表达式可表示为________,若只改变一个影响因素,当平衡移动时,K值________变化(填“一定”或“不一定”);当K值变大时,逆反应速率________.(填“增大”、“减小”或“不变”)
(2)该反应达到平衡时下列说活错误的是________。
a.容器内压强保持不变
b.氢气和水蒸汽的物质的量之比保持不变
c.加入少量Fe2O3固体,平衡向逆反应方向移动
d.移除部分Na2S固体,平衡向正反应方向移动
(3)该温度下,在2L盛有2.74g Na2SO4的密闭容器中通入H2气体,10分钟后测得固体质量为2.164g。则10分钟内H2的平均反应速率________。
(4)请写出向Ba(ClO)2溶液中通入足量SO2气体后所发生化学反应的离子方程式____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据美国《科学》杂志报道,外太空的某一星球的大气层中,含有大量的CH2=CHOH,此物质常温时为液体,它很容易转化成CH3CHO,化学方程式为CH2=CHOH![]() CH3CHO;已知ΔH<0。据此你认为下列说法中错误的是
CH3CHO;已知ΔH<0。据此你认为下列说法中错误的是
A.该星球表面温度很高B.该星球表面温度很低
C.该反应为放热反应D.高温下稳定性CH2=CHOH>CH3CHO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com