
【题目】运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.CO还原NO的脱硝反应:2CO(g)+2NO(g)2CO2(g)+N2(g) △H
(1)已知:CO(g)+NO2(g) CO2(g)+NO(g) △H1=-226kJ·mol-1
N2(g)+2O2(g)2NO2(g) △H2=+68kJ·mol-1
N2(g)+O2(g)2NO(g) △H3=+183kJ·mol-1
脱硝反应△H=___,有利于提高NO平衡转化率的条件是___(写出两条)。
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以Ag-ZSM-5为催化剂,对CO、NO催化转化进行研究,测得NO转化为N2的转化率随温度、CO混存量的变化情况如图所示。
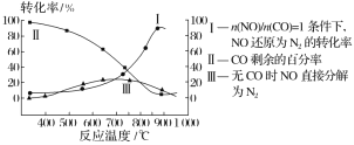
若不使用CO,温度超过775℃,发现NO的分解率降低,其可能的原因为____。
【答案】-750kJ·mol-1 降温、升压、增大CO和NO的投料比等 该反应是放热反应,升高温度反应更有利于向逆反应方向进行
【解析】
(1)①CO(g)+NO2(g) CO2(g)+NO(g) △H1=-226kJ·mol-1
②N2(g)+2O2(g)2NO2(g) △H2=+68kJ·mol-1
③N2(g)+O2(g)2NO(g) △H3=+183kJ·mol-1
根据盖斯定律可知反应①×2+反应②-反应③×2可得2CO(g)+2NO(g)2CO2(g)+N2(g),并可进一步计算反应热;提高NO的转化率,只需让平衡正向移动;
(2)升高温度,NO的分解率降低,说明反应逆向移动,该反应放热,据此分析作答。
(1)由分析可知反应①×2+反应②-反应③×2可得2CO(g)+2NO(g)2CO2(g)+N2(g),△H=-750kJ·mol-1;提高NO的转化率,只需让平衡正向移动,可选择降低温度、增大压强或增大CO和NO的投料比等方法;
(2)该反应为放热反应,升高温度,反应逆向移动,NO的分解率降低。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】中学实验中,通常利用如图所示的装置进行喷泉实验,来验证气体的“溶解性”,下列有关说法不正确的是( )

A.用滴管加入液体后,由于气体的“溶解”,使瓶内压强减小,导致瓶内压强小于外界压强,从而形成喷泉
B.选用合适的溶液,CO2也能用于做喷泉实验
C.HCl、NH3和SO2均能用该装置做喷泉实验
D.用NO2和N2O4的混合气体做喷泉实验,烧瓶中将充满稀硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常把原子总数和价电子总数相同的分子或离子称为等电子体,等电子体具有相似的化学结构,则下列有关说法中正确的是![]()
A.![]() 和
和![]() 是等电子体,化学键类型完全相同
是等电子体,化学键类型完全相同
B.![]() 和
和![]() 是等电子体,均为平面正三角形结构
是等电子体,均为平面正三角形结构
C.![]() 和
和![]() 是等电子体,均为三角锥形结构
是等电子体,均为三角锥形结构
D.![]() 和
和![]() 是等电子体,
是等电子体,![]() 和
和![]() 具有相同的化学性质
具有相同的化学性质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为更有效处理工业废气中排放的氮氧化物(NOx)、SO2等,减少大气污染。科学家不断对相关反应进行研究尝试。
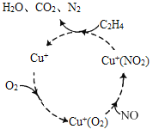
(1)脱硝反应机理如图,Cu+的作用是___,C2H4参与的反应方程式__。
(2)选择性催化还原技术(SCR)是目前较为成熟的烟气脱硝技术,其反应原理主要为:4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g);ΔH=-1627kJmol-1
4N2(g)+6H2O(g);ΔH=-1627kJmol-1
①该方法应控制反应温度在315~400℃之间,反应温度不宜过高的原因是__。
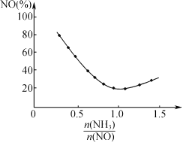
②氨氮比n(NH3)/n(NO)![]() 会直接影响该方法的脱硝率。如图为350℃时,只改变氨气的投放量,NO的百分含量与氨氮比的关系图。当
会直接影响该方法的脱硝率。如图为350℃时,只改变氨气的投放量,NO的百分含量与氨氮比的关系图。当![]() >1.0时,烟气中NO含量反而增大,主要原因是___。
>1.0时,烟气中NO含量反而增大,主要原因是___。
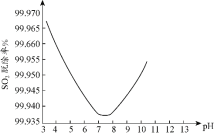
(3)烟气脱硫、脱硝一体化技术是大气污染防治研究的热点。ClO2及NaClO2均是性能优良的脱硫脱硝试剂。
某研究小组用ClO2进行单独脱除SO2实验时,测得SO2的脱除率随溶液pH变化如图所示。当3<pH<7时,随pH的增大,SO2脱除率逐渐降低,其原因是___;在pH约7.8之后,随pH的增大,SO2脱除率又开始升高,其原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
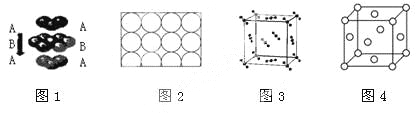
A.钛和钾都采取图1的堆积方式
B.图2为金属原子在二维空间里的非密置层放置,此方式在三维空间里堆积,仅得简单立方堆积
C.图3是干冰晶体的晶胞,晶胞棱长为a cm,则在每个CO2周围距离相等且为![]() cm的CO2有8个
cm的CO2有8个
D.图4这种金属晶体的晶胞,是金属原子在三维空间里以密置层采取ABCABC…堆积的结果
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配平下列氧化还原反应方程式:
(1)______![]() ______HCl—______
______HCl—______![]() ______
______![]() ______
______![]() ______
______![]()
(2)______![]() ______
______![]() ______
______![]() ______
______![]() ______
______![]() ______H2O
______H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是来自石油的重要有机化工原料,其产量通常用来衡量一个国家的石油化工发展水平,结合图1中路线回答:
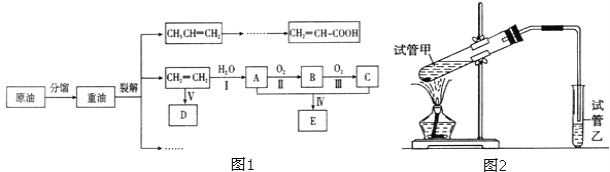
已知:2CH3CHO+O2![]() 2CH3COOH
2CH3COOH
(1)上述过程中属于物理变化的是______________(填序号)。①分馏②裂解
(2)反应II的化学方程式是______________。
(3)D为高分子化合物,可以用来制造多种包装材料,其结构简式是______________。
(4)E是有香味的物质,在实验室中可用图2装置制取。
①反应IV的化学方程式是______________。
②试管乙中的导气管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是______________。
(5)根据乙烯和乙酸的结构及性质进行类比,关于有机物CH2=CH-COOH的说法正确的是______________。
①与CH3COOH互为同系物
②可以与NaHCO3溶液反应放出CO2气体
③在一定条件下可以发生酯化、加成、氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①已知白磷和氯酸溶液可发生如下反应,将该反应进行配平:
______P4+_______HClO3+_______ ______=______HCl+____H3PO4
②白磷有毒,有实验室可采用CuSO4溶液进行处理,其反应为:11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4
在该反应中30 mol CuSO4可氧化P4的物质的量是______mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示。(电极材料为石墨)
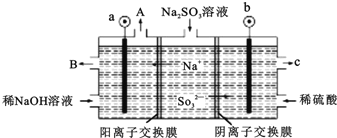
(1)写出用过量的NaOH溶液吸收烟气中的SO2的方程式___。
(2)图中a极要连接电源的(填“正”或“负”)___极,C口流出的物质是___。
(3)SO32放电的电极反应式为___。
(4)电解过程中阴极区碱性明显增强,用平衡移动原理解释原因___。
(二)一定条件下,NO2与SO2反应生成SO3和NO两种气体:NO2(g)+SO2(g)SO3(g)+NO(g),将体积比为1:2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是___
A.体系压强保持不变 B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变 D.每消耗1molSO2的同时生成1molNO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com