
【题目】下列说法正确的是
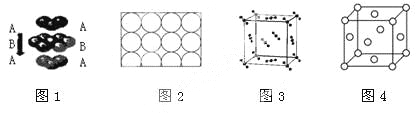
A.钛和钾都采取图1的堆积方式
B.图2为金属原子在二维空间里的非密置层放置,此方式在三维空间里堆积,仅得简单立方堆积
C.图3是干冰晶体的晶胞,晶胞棱长为a cm,则在每个CO2周围距离相等且为![]() cm的CO2有8个
cm的CO2有8个
D.图4这种金属晶体的晶胞,是金属原子在三维空间里以密置层采取ABCABC…堆积的结果
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是( )
A.0.1mol·L-1NaHCO3溶液:Na+、Ba2+、NO3-、OH-
B.0.1mol·L-1NaAlO2溶液:K+、OH-、Cl-、NO3-
C.![]() =1.0×1012的溶液:Fe2+、Mg2+、NO3-、I-
=1.0×1012的溶液:Fe2+、Mg2+、NO3-、I-
D.0.1mol·L-1FeCl3溶液:K+、Cu2+、SCN-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Z具有广谱抗菌活性,可利用X和Y反应获得。下列有关说法正确的是( )
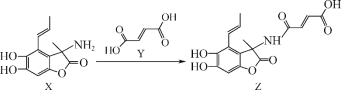
A.有机物X的分子式为C12H13O4N
B.有机物Y可以和乙醇发生缩聚反应
C.有机物Y中所有原子可能在同一平面上
D.1mol有机物Z与足量NaOH溶液反应最多消耗4mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天门冬氨酸锌是一种补锌剂,可以用天门冬氨酸(![]() )和锌的化合物为原料制备。
)和锌的化合物为原料制备。
(1)天门冬氨酸分子中氮原子的轨道杂化类型为___;天门冬氨酸所含σ键和π键的数目之比为___;其所含四种元素电负性由大到小的顺序为___。
(2)Zn(NO3)2中所含NO![]() 的空间构型为___(用文字描述)。
的空间构型为___(用文字描述)。
(3)工业ZnCl2中常混有杂质TiCl4,TiCl4室温下为无色液体,熔沸点低,易升华,可溶于甲苯和氯代烃等非极性溶剂中,它的晶体类型是___。Ti的价电子排布式为___。
(4)ZnO的晶胞结构如图所示,Zn2+的配位数为___。
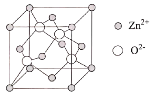
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于水溶液中的离子平衡问题叙述正确的是( )
A.将10mL0.1mol·L-1盐酸加入到10mL0.1mol·L-1碳酸钠溶液中:c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-)
B.0.02mol·L-1HCN溶液与0.02mol·L-1NaCN溶液等体积混合:c(HCN)+c(CN-)=0.04mol·L-1
C.等物质的量浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3·H2O;c(NH4+) 由大到小的顺序是:①=②>③>④
D.向0.01mol·L-1醋酸溶液中加水,稀释后溶液中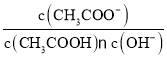 比值增大(忽略稀释过程中溶液温度变化)
比值增大(忽略稀释过程中溶液温度变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.CO还原NO的脱硝反应:2CO(g)+2NO(g)2CO2(g)+N2(g) △H
(1)已知:CO(g)+NO2(g) CO2(g)+NO(g) △H1=-226kJ·mol-1
N2(g)+2O2(g)2NO2(g) △H2=+68kJ·mol-1
N2(g)+O2(g)2NO(g) △H3=+183kJ·mol-1
脱硝反应△H=___,有利于提高NO平衡转化率的条件是___(写出两条)。
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以Ag-ZSM-5为催化剂,对CO、NO催化转化进行研究,测得NO转化为N2的转化率随温度、CO混存量的变化情况如图所示。
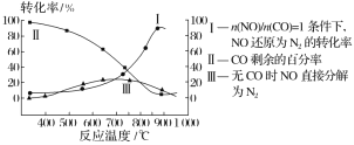
若不使用CO,温度超过775℃,发现NO的分解率降低,其可能的原因为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下反应2SO2(g)+O2(g)![]() 2SO3(g)在恒容密闭容器中进行,从反应开始至10s时,O2的浓度减少了0.3mol·L-1。则0~10s内平均反应速率为
2SO3(g)在恒容密闭容器中进行,从反应开始至10s时,O2的浓度减少了0.3mol·L-1。则0~10s内平均反应速率为
A.v(O2)=0.03mol·L-1·s-1B.v(O2)=0.3mol·L-1·s-1
C.v(SO2)=0.03mol·L-1·s-1D.v(SO3)=0.03mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题。
(1)工业尾气中含有大量的氮氧化物,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:
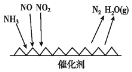
①由图可知SCR技术中的氧化剂为____。
②用Fe作催化剂加热时,在氨气足量的情况下,当NO2与NO的物质的量之比为1:1时,写出该反应的化学方程式:_______。
(2)ClO2气体是一种常用的消毒剂,现在被广泛用于饮用水消毒。自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8 mg/L。碘量法可以检测水中ClO2的浓度,步骤如下:
Ⅰ.取一定体积的水样用微量的氢氧化钠溶液调至中性,然后加入一定量的碘化钾,并加入淀粉溶液,溶液变蓝![]()
Ⅱ.加入一定量的Na2S2O3溶液(已知:2S2O32-+I2=S4O62-+2I-)
Ⅲ.加硫酸调节水样pH至1.3。
已知:ClO2在中性条件下还原产物为ClO2-,在酸性条件下还原产物为Cl-。请回答下列问题:
①确定操作Ⅱ完全反应的现象为________。
②在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式为______。
③若水样的体积为1.0 L,在操作Ⅱ时消耗了1.0×10-3 mol/L的Na2S2O3溶液10 mL,则水样中ClO2的浓度是____mg/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制取水煤气的反应为C(s)+H2O(g) ![]() CO(g)+H2(g) ΔH>0;在一定条件下达到化学平衡后,在时间为t时突然改变条件,反应速率的变化如图所示,在t时所改变的条件是( )
CO(g)+H2(g) ΔH>0;在一定条件下达到化学平衡后,在时间为t时突然改变条件,反应速率的变化如图所示,在t时所改变的条件是( )

A.加压 B.升温 C.增大水蒸气浓度 D.增大碳的物质的量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com