
【题目】为更有效处理工业废气中排放的氮氧化物(NOx)、SO2等,减少大气污染。科学家不断对相关反应进行研究尝试。
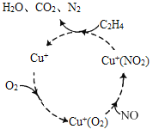
(1)脱硝反应机理如图,Cu+的作用是___,C2H4参与的反应方程式__。
(2)选择性催化还原技术(SCR)是目前较为成熟的烟气脱硝技术,其反应原理主要为:4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g);ΔH=-1627kJmol-1
4N2(g)+6H2O(g);ΔH=-1627kJmol-1
①该方法应控制反应温度在315~400℃之间,反应温度不宜过高的原因是__。
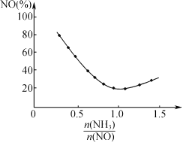
②氨氮比n(NH3)/n(NO)![]() 会直接影响该方法的脱硝率。如图为350℃时,只改变氨气的投放量,NO的百分含量与氨氮比的关系图。当
会直接影响该方法的脱硝率。如图为350℃时,只改变氨气的投放量,NO的百分含量与氨氮比的关系图。当![]() >1.0时,烟气中NO含量反而增大,主要原因是___。
>1.0时,烟气中NO含量反而增大,主要原因是___。
(3)烟气脱硫、脱硝一体化技术是大气污染防治研究的热点。ClO2及NaClO2均是性能优良的脱硫脱硝试剂。
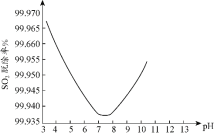
某研究小组用ClO2进行单独脱除SO2实验时,测得SO2的脱除率随溶液pH变化如图所示。当3<pH<7时,随pH的增大,SO2脱除率逐渐降低,其原因是___;在pH约7.8之后,随pH的增大,SO2脱除率又开始升高,其原因是___。
【答案】催化剂 2C2H4+6Cu+(NO2)=3N2+4CO2+4H2O+6Cu+ 正反应放热,温度过高会降低NO的转化率 NH3和O2再次反应生成NO(或4NH3+5O2=4NO+6H2O) pH<7时,随着pH值的增大,ClO2的稳定性降低氧化性减弱,SO2的脱除率降低 当pH>7.8后,随着碱性的增强,生成ClO2-增多,氧化性增强,SO2的脱除率上升
【解析】
(1)根据图象可知,Cu+在反应前后不变,乙烯与O2、NO在Cu+作用下生成CO2、N2和H2O,以此分析作答;
(2)①根据温度对反应速率和化学平衡的影响进行分析;
②NH3与O2反应生成NO;
(3)根据题意可知ClO2在酸性条件下稳定,酸性减弱,ClO2氧化性减弱;随着pH的增大,ClO2在碱性条件下可发生歧化反应生成亚氯酸盐,亚氯酸盐具有强氧化性。
(1)根据图象可知,Cu+在反应前后不变,乙烯与O2、NO在Cu+作用下生成CO2、N2和H2O,反应方程式为:2C2H4+6Cu+(NO2)=3N2+4CO2+4H2O+6Cu+;
(2)①该反应为放热反应,温度过高,使脱硝的主要反应平衡逆向移动,脱硝率降低;
②当![]() >1.0时,过量的NH3与O2反应生成NO,所以烟气中NO的浓度增大,烟气中NO的含量增大;
>1.0时,过量的NH3与O2反应生成NO,所以烟气中NO的浓度增大,烟气中NO的含量增大;
(3)根据题意可知ClO2在酸性条件下稳定,具有强氧化性,因此当3<pH<7时,随pH的增大,SO2脱除率逐渐降低;在pH>7.8时,随pH的增大,ClO2在碱性条件下可发生歧化反应生成亚氯酸盐,亚氯酸盐具有强氧化性,SO2脱除率又开始升高。


科目:高中化学 来源: 题型:
【题目】Al及其化合物在工业上有极其广泛的用途,
(1)焊接钢轨时用Al冶炼Fe的反应方程式为______;铝的化合物明矾可用于净水,其原理用离子方程式解释为___________。
(2)硅藻遗骸中主要成分是Al2O3、SiO2和Fe2O3。从中获取Al(OH)3的过程如下:
步骤I:取适量硅藻遗骸用70%H2SO4浸泡;
步骤II:向上述浸泡液中加入过量NaOH并过滤;
步骤III:向上述滤液中通入过量CO2过滤得到Al(OH)3。
①用70%H2SO4浸取硅藻遗骸的目的是________。
②步骤II中涉及铝元素的离子方程式为______;
③步骤III中能否用HCl代替CO2?_____(填“能”或“不能”);该步骤所得滤液中存在的电荷守恒式为_______;向该滤液中滴加少量NaOH溶液,则![]() ____填(“变大”、“变小”或“不变”)
____填(“变大”、“变小”或“不变”)
(3)Al(OH)3可用作阻热材料,试从Al(OH)3的化学性质角度分析其原因________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常用补钙片的有效成分是CaCO3,某化学探究小组欲测定某补钙片中碳酸钙的含量。查阅资料得知:
一种常用的分析试剂 EDTA二钠盐(用Na2H2Y2H2O表示)可用于测定Ca2+,其反应为:
Ca2++H2Y2-=CaY2-+2H+,以铬黑T为指示剂,滴定终点溶液由红色变为蓝色。于是该实验小组做了如下实验:
步骤一:配制待测溶液。取适量补钙片研碎后,准确称取0.400g配成250mL溶液。
步骤二:滴定。用移液管取待测液25.00mL于锥形瓶中,加入适量NaOH溶液,摇
匀,再加入铬黑T指示剂3滴,用0.0100molL1EDTA二钠盐溶液滴定至终点。三次重复滴定平均消耗EDTA二钠盐溶液22.50mL。
请回答下列问题:
(1)步骤一中补钙剂要用2mol/L的盐酸溶解,反应的离子方程式为__________________,配制待测溶液所必需的仪器除研钵、药匙、分析天平、称量瓶、烧杯、玻璃棒外,还有_______、________,操作的先后顺序为:e→____→____→d→f→____→____→____(填下列操作的序号)。
A.盐酸溶解 b.称量 c.定容摇匀 d.加蒸馏水稀释 e.研磨
f.用NaOH溶液调节溶液pH至7 g.转移溶液 h.洗涤并转移
(2)实验测得补钙片中CaCO3的含量为_______。
(3)下列操作会导致测定结果偏高的是_______(填下列选项的字母序号)。
A.未将洗涤烧杯内壁的溶液转入容量瓶
B.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水
C.定容时俯视刻度线
D.滴定管下端尖嘴中有气泡存在,滴定后气泡消失
E.滴定管用蒸馏水洗净后未用标准液润洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1mol·L-1某一元酸HA的电离平衡常数约为1×10-7,下列叙述错误的是( )
A. 该溶液的pH=4
B. 此溶液中,HA约有0.1%发生电离
C. 加水稀释,HA的电离平衡向右移动,HA的电离平衡常数增大
D. 由HA电离出的c(H+)约为水电离出的c(H+)的106倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天门冬氨酸锌是一种补锌剂,可以用天门冬氨酸(![]() )和锌的化合物为原料制备。
)和锌的化合物为原料制备。
(1)天门冬氨酸分子中氮原子的轨道杂化类型为___;天门冬氨酸所含σ键和π键的数目之比为___;其所含四种元素电负性由大到小的顺序为___。
(2)Zn(NO3)2中所含NO![]() 的空间构型为___(用文字描述)。
的空间构型为___(用文字描述)。
(3)工业ZnCl2中常混有杂质TiCl4,TiCl4室温下为无色液体,熔沸点低,易升华,可溶于甲苯和氯代烃等非极性溶剂中,它的晶体类型是___。Ti的价电子排布式为___。
(4)ZnO的晶胞结构如图所示,Zn2+的配位数为___。
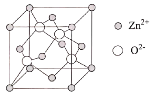
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同价态氯(或卤素)的归中或歧化反应,试写出下列反应的离子方程式。
(1)次氯酸钠与盐酸反应:________________________。
(2)酸化NaIO3和NaI的混合溶液:_____________________。
(3)氯气通入热的氢氧化钾溶液(生成物中检测出含有氯酸钾):_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.CO还原NO的脱硝反应:2CO(g)+2NO(g)2CO2(g)+N2(g) △H
(1)已知:CO(g)+NO2(g) CO2(g)+NO(g) △H1=-226kJ·mol-1
N2(g)+2O2(g)2NO2(g) △H2=+68kJ·mol-1
N2(g)+O2(g)2NO(g) △H3=+183kJ·mol-1
脱硝反应△H=___,有利于提高NO平衡转化率的条件是___(写出两条)。
(2)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究小组在实验室以Ag-ZSM-5为催化剂,对CO、NO催化转化进行研究,测得NO转化为N2的转化率随温度、CO混存量的变化情况如图所示。
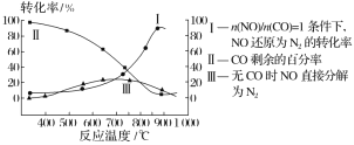
若不使用CO,温度超过775℃,发现NO的分解率降低,其可能的原因为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G是几种烃的分子球棍模型,据此回答下列问题:
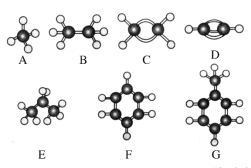
(1)常温下含碳量最高的气态烃是___(填对应字母);
(2)A分子的空间构型是___;
(3)G的一氯代物有___种;E的二氯代物有___种;
(4)写出C与溴的四氯化碳溶液反应的化学方程式__,反应类型为___。
(5)写出F与浓硝酸和浓硫酸反应的化学方程式___,反应类型为___。
现有上面A、B、C三种有机化合物:(以下均用结构简式作答)
(6)同状况、同体积的以上三种物质完全燃烧时耗去O2的量最多的是___。
(7)等质量的以上三种物质燃烧时,生成二氧化碳最多的是___,生成水最多的是___。
(8)在120℃、1.01×105Pa时,有两种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,向Cu(IO3)2饱和溶液中加入足量的经稀硫酸酸化的KI溶液,产生CuI沉淀,溶液由蓝色变为棕黄色,反应前加入淀粉溶液不变蓝,反应后加入淀粉溶液变为蓝色。
(1)该反应中氧化剂是 ______ ;
(2)该反应的还原产物是 ______ ;
(3)1 mol氧化剂在反应中得到电子的物质的量为 ______ ;
(4)某反应体系中有物质:Bi2(SO4)3、NaMnO4、H2O、MnSO4、NaBiO3、Na2SO4、H2SO4请将NaBiO3之外的反应物与生成物分别填入以下空格内,配平化学计量数,并在氧化剂与还原剂之间标出电子转移的方向和数目。
_________NaBiO3+_____ ________ + _____ ________→_____ _______ + ______ ________+ ______ _______+ ______ _______。
_____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com