
【题目】向含有0.2 mol NaOH和0.1 mol Ba(OH)2的溶液中持续稳定地通入CO2气体,当通入气体为8.96 L(0 ℃,1.01×105Pa)时立即停止,则这一过程中,溶液中离子的物质的量与通入CO2气体的体积关系图像正确的是(气体的溶解和离子的水解忽略不计)( )。

【答案】C
【解析】试题分析:n(CO2)=![]() =0.4mol,通入含有0.2molNaOH和0.1molBa(OH)2的溶液中,相当于首先发生:Ba2++2OH-+CO2=BaCO3↓,0.1molBa(OH)2完全反应消耗0.1molCO2,剩余0.2molOH-,生成0.1molBaCO3,然后发生2OH-+CO2=CO32-+H2O,消耗0.1molCO2,生成0.1molCO32-,上述两阶段共消耗0.2molCO2,剩余0.2molCO2,再发生CO32-+CO2+H2O=2HCO3-,消耗0.1molCO2,最后发生BaCO3+CO2+H2O=Ba2++2HCO3-,碳酸钡与二氧化碳恰好反应,据此计算解答.
=0.4mol,通入含有0.2molNaOH和0.1molBa(OH)2的溶液中,相当于首先发生:Ba2++2OH-+CO2=BaCO3↓,0.1molBa(OH)2完全反应消耗0.1molCO2,剩余0.2molOH-,生成0.1molBaCO3,然后发生2OH-+CO2=CO32-+H2O,消耗0.1molCO2,生成0.1molCO32-,上述两阶段共消耗0.2molCO2,剩余0.2molCO2,再发生CO32-+CO2+H2O=2HCO3-,消耗0.1molCO2,最后发生BaCO3+CO2+H2O=Ba2++2HCO3-,碳酸钡与二氧化碳恰好反应,据此计算解答.
解答:解:含有0.2mol NaOH和0.1mol Ba(OH)2的溶液中离子总的物质的量为0.2mol×2+0.1mol×3=0.7mol,
n(CO2)=![]() =0.4mol,
=0.4mol,
通入含有0.2molNaOH和0.1molBa(OH)2的溶液中,相当于首先发生:Ba2++2OH-+CO2=BaCO3↓,该阶段0.1molBa(OH)2完全反应消耗0.1molCO2,体积为2.24L,离子物质的量减少0.3mol,溶液中离子物质的量为0.7mol-0.3mol=0.4mol,其中含有0.2molOH-、生成0.1molBaCO3;
然后发生2OH-+CO2=CO32-+H2O,0.2molOH-完全反应消耗0.1molCO2,体积为2.24L,该阶段离子物质的量减少0.1mol,溶液中剩余离子物质的量为0.4mol-0.1mol=0.3mol,溶液中含有0.2molNa+、0.1molCO32-;
再发生CO32-+CO2+H2O=2HCO3-,消耗0.1molCO2,体积为2.24L,溶液中离子物质的量增大0.1mol,溶液中离子为0.4mol;
最后发生BaCO3+CO2+H2O=Ba2++2HCO3-,碳酸钡与二氧化碳恰好反应,消耗0.1molCO2,体积为2.24L,溶液中离子物质的量增大0.3mol,溶液中中离子为0.7mol;故图象C符合,故选C.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】为测定某氟化稀土样品中氟元素的质量分数,某化学兴趣小组进行如下了实验。
利用高氯酸(高沸点酸)将样品中的氟元素转化为氟化氢(低沸点酸)蒸出,再通过滴定测量。
实验装置如图所示。

(1)a的作用是____________,仪器d的名称是________________ 。
(2)检查装置气密性:____________(填操作),关闭k,微热c,导管e末端有气泡冒出;停止加热,导管e内有一段稳定的水柱,说明装置气密性良好。
(3)c中加入一定体积高氯酸和mg氟化稀土样品,Z中盛有滴加酚酞的NaOH溶液。加热b、c,使b中产生的水蒸气进入c。
①下列物质可代替高氯酸的是_________(填序号)。
A.硝酸 B.盐酸 C.硫酸 D.磷酸
②实验中除有HF气体外,可能还有少量SiF4(易水解)气体生成。若有SiF4生成,实验结果将__________(填“偏高”“ 偏低”或“不受影响”)。
③若观察到f中溶液红色褪去,需要向f中及时补加NaOH溶液,否则会使实验结果偏低,原因是______________。
(4)向馏出液中加入V1mL c1mol·L-1La(NO3)3溶液,得到LaF3沉淀,再用c2mol·L-1EDTA标准溶液滴定剩余La3+(La3+与EDTA按1:1络合),消耗EDTA标准溶液V2ml,则氟化稀土样品中氟的质量分数为______________。
(5)用样品进行实验前,需要用0.084g氟化钠代替样品进行实验,改变条件(高氯酸用量、反应温度、蒸馏时间),测量并计算出氟元素质量,重复多次。该操作的目的是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值, 下列有关叙述正确的是
A. 1 mol OH-所含电子数为10NA
B. 2 L 0.5 mol·L-1Na2SO4溶液中阴离子所带电荷数为0.2NA
C. 标准状况下,1.12 LH2O 含有的氢原子数为0.1NA
D. 14 g由CO和N2组成的混合气体中含有的分子总数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1894年,Fenton发现采用Fe2+和H2O2混合溶液,能产生具有高反应活性和强氧化性的羟基自由基(-OH),从而氧化降解有机污染物,称为Fenton反应。电Fenton法采用惰性电极电解法,右图为其中一个电极的反应机理,其中含有Fenton反应。下列说法不正确的是( )
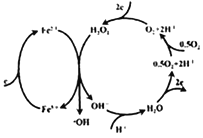
A. 羟基自由基(-OH)的电子式为:![]()
B. 右图所在的惰性电极应与外接电源的负极相连
C. Fenton反应:Fe2++H2O2==Fe3++OH-+-OH
D. 右图所在的惰性电极每消耗22.4LO2(标准状况),理论上在外电电路中转移4mole-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1.52g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况}。向反应后的溶液中加入1.0mol/LNaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀。下列说法不正确的是
A. 该合金中铜与铁的物质的量之比是2:1
B. 该浓硝酸中HNO3的物质的量浓度是14.0mol/L
C. 得到2.54g沉淀时,加入NaOH溶液的体积是600mL
D. NO2和N2O4的混合气体中,NO2的体积分数是80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于芳香族化合物的叙述正确的是()
A. 是苯和苯的同系物
B. 符合通式CnH2n-6(n≥6)的化合物
C. 是分子中含有苯环的烃
D. 是分子中含有苯环的有机物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,研究NO2、NO、CO等大气污染物处理对建设美丽中国具有重要意义。
(1) 已知: ①NO2+CO![]() CO2+NO 该反应的平衡常数为K1(下同)
CO2+NO 该反应的平衡常数为K1(下同)
每1mol 下列物质分解为气态基态原子消耗能量分别为
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g) ![]() 2NO(g) △H=+ 179.5 kJ /mol K2
2NO(g) △H=+ 179.5 kJ /mol K2
③2NO(g) + O2(g) ![]() 2NO2(g) △H=-112.3kJ/mol K3
2NO2(g) △H=-112.3kJ/mol K3
试写出NO与CO反应生成无污染物气体的热化学方程式_______________________以及此热化学方程式的平衡常数K=________(用K1、 K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO![]() 4CO2+N2,某温度下,在1L密闭容器中充入0.1molNO2和0.2molCO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的
4CO2+N2,某温度下,在1L密闭容器中充入0.1molNO2和0.2molCO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的![]() ,则反应开始到平衡时CO的平均反应速率v(CO)=___________。
,则反应开始到平衡时CO的平均反应速率v(CO)=___________。
若此温度下,某时刻测得NO2、CO、CO2、N2的浓度分别为amo/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,a的取值范围__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com