
【题目】“绿水青山就是金山银山”,研究NO2、NO、CO等大气污染物处理对建设美丽中国具有重要意义。
(1) 已知: ①NO2+CO![]() CO2+NO 该反应的平衡常数为K1(下同)
CO2+NO 该反应的平衡常数为K1(下同)
每1mol 下列物质分解为气态基态原子消耗能量分别为
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g) ![]() 2NO(g) △H=+ 179.5 kJ /mol K2
2NO(g) △H=+ 179.5 kJ /mol K2
③2NO(g) + O2(g) ![]() 2NO2(g) △H=-112.3kJ/mol K3
2NO2(g) △H=-112.3kJ/mol K3
试写出NO与CO反应生成无污染物气体的热化学方程式_______________________以及此热化学方程式的平衡常数K=________(用K1、 K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO![]() 4CO2+N2,某温度下,在1L密闭容器中充入0.1molNO2和0.2molCO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的
4CO2+N2,某温度下,在1L密闭容器中充入0.1molNO2和0.2molCO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的![]() ,则反应开始到平衡时CO的平均反应速率v(CO)=___________。
,则反应开始到平衡时CO的平均反应速率v(CO)=___________。
若此温度下,某时刻测得NO2、CO、CO2、N2的浓度分别为amo/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,a的取值范围__________。
【答案】 2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H=-759.8kJ/mol K =
N2(g)+2CO2(g) △H=-759.8kJ/mol K =![]() 0.008mol/(L·s) 0≤a<0.8(或a<0.8)
0.008mol/(L·s) 0≤a<0.8(或a<0.8)
【解析】(1)①根据焓变=反应物总键能-生成物总键能,则反应NO2(g)+CO(g) ![]() CO2(g)+NO(g)△H1=(812+1076-1490-632)kJ/mol=234kJ/mol,②N2(g)+O2(g)
CO2(g)+NO(g)△H1=(812+1076-1490-632)kJ/mol=234kJ/mol,②N2(g)+O2(g)![]() 2NO(g) △H=+179.5kJ/mol,③2NO(g)+ O2(g)
2NO(g) △H=+179.5kJ/mol,③2NO(g)+ O2(g)![]() 2NO2(g) △H=-112.3kJ/mol,根据盖斯定律,由③+①×2-②得反应2NO(g)+ 2CO(g)
2NO2(g) △H=-112.3kJ/mol,根据盖斯定律,由③+①×2-②得反应2NO(g)+ 2CO(g) ![]() N2(g)+2CO2(g) △H=△H3+△H1×2-△H2 =-112.3kJ/mol+(-234kJ/mo1)×2-179.5kJ/mol =-759.8kJ/mol,当总反应式相加时平衡常数相乘、相减时相除、成倍时为幂,则平衡常数K=
N2(g)+2CO2(g) △H=△H3+△H1×2-△H2 =-112.3kJ/mol+(-234kJ/mo1)×2-179.5kJ/mol =-759.8kJ/mol,当总反应式相加时平衡常数相乘、相减时相除、成倍时为幂,则平衡常数K=![]() ,故答案为:2NO(g)+2CO(g)
,故答案为:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) △H=-759.8kJ/mol;
N2(g)+2CO2(g) △H=-759.8kJ/mol; ![]() ;
;
(2)设达到平衡时NO2的浓度改变x,
2NO2 + 4CO![]() 4CO2 + N2
4CO2 + N2
起始浓度(mol/L):0.1 0.2 0 0
改变浓度mol/L): x 2x 2x 0.5x
平衡浓度(mol/L):0.1-x 0.2-2x 2x 0.5x
故![]() =
=![]() ,解得x=0.02mo/L,v(CO)=
,解得x=0.02mo/L,v(CO)= ![]() =0.008mol/(L·s);K=
=0.008mol/(L·s);K= =
=![]() ,若此温度下,某时刻测得NO2、CO、CO2、N2的浓度分别为amol/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,则Qc=
,若此温度下,某时刻测得NO2、CO、CO2、N2的浓度分别为amol/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,则Qc= =
=![]() <K=
<K=![]() ,解得a<0.8,a的取值范围为0a<0.8,故答案为:0.008mol/(L·s);0≤a<0.8(或a<0.8)。
,解得a<0.8,a的取值范围为0a<0.8,故答案为:0.008mol/(L·s);0≤a<0.8(或a<0.8)。


科目:高中化学 来源: 题型:
【题目】向含有0.2 mol NaOH和0.1 mol Ba(OH)2的溶液中持续稳定地通入CO2气体,当通入气体为8.96 L(0 ℃,1.01×105Pa)时立即停止,则这一过程中,溶液中离子的物质的量与通入CO2气体的体积关系图像正确的是(气体的溶解和离子的水解忽略不计)( )。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据CH2=CH﹣CH2COOH的结构,它不可能发生的反应是( )
A.与银氨溶液反应析出银
B.使溴的四氯化碳溶液褪色
C.与乙醇在浓硫酸催化下发生酯化反应
D.与新制氢氧化铜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。

下列说法正确的是( )
A. 沸点A2D<A2X
B. CA3分子是非极性分子
C. C形成的单质中σ键与π键个数之比为1∶2
D. B、C、D形成的气态氢化物互为等电子体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组设计下图实验装置(夹带装置略去)制备Cl2,并探究氯气的相关性质。
已知: 硫代硫酸钠(Na2S2O3)溶液在工业上可作脱氯剂。
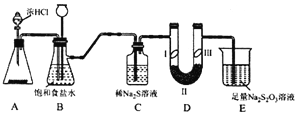
(1)若A装置中固体药品为KMnO4,产生标况下3.36L氯气时,被氧化的HCl的物质的量为___。
(2)装置B的作用是_____________。
(3)装置C的作用是探究氯气与Na2S溶液反应。反应开始后,观察到C中产生黄色沉淀。写出该反应的化学方程式_____________。
(4)装置D的作用是验证氯气是否具有漂白性,I处是湿润的有色布条,则II、III处应加入的物质分别是__________、____________。
【探究与反思】
按图中设计装置进行实验,甲同学观察到C中先产生黄色沉淀。但是长时间通入氯气后,溶液又变澄清,该同学思考后设计如下实验检验C中生成物的成分。
实验操作步骤:
①取少量原Na2S溶液于小试管中,滴加BaCl2溶液,无明显现象;
②取少量反应后C中澄清溶液于小试管中,滴加过量的盐酸,无气泡冒出,再滴加BaCl2溶液,产生白色沉淀。
(5)该同学根据实验现象得出结论:装置C 中生成的含硫元素的物质是______ (填化学式)。推测过量的氯气与Na2S溶液反应的离子方程式为________________。
(6)请用离子方程式说明装置E的作用______________。
(7)乙同学认真思考后认为装置E中的试剂不合理。请用离子方程式和必要的文字解释原因:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是CO2电催化还原为CH4的工作原理示意图。下列说法不正确的是( )

A. 该过程是电能转化为化学能的过程
B. 铜电极的电极反应式为CO2+8H++8e-=CH4+2H2O
C. 一段时间后,① 池中n(KHCO3)不变
D. 一段时间后,② 池中溶液的pH一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)=3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A. v(A)=0.5mol·(L· s)-1 B. v(B)=0.3 mol·(L· s)-1
C. v(C)=0.8 mol·(L· s)-1 D. v(D)=1 mol·(L· s)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是()
A. 能电离出离子的化合物都是离子化合物
B. 熔融状态下能导电的化合物一定是离子化合物
C. 不同元素组成的多原子分子里的化学键一定是极性键
D. 非金属元素构成的单质中一定存在共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com