
【题目】下列离子检验的方法正确的是
A.检验![]() :取样后加入盐酸,产生使澄清石灰水变浑浊的气体
:取样后加入盐酸,产生使澄清石灰水变浑浊的气体
B.检验![]() :取样后加入氯化钡溶液,生成白色沉淀,再加入盐酸沉淀不溶解
:取样后加入氯化钡溶液,生成白色沉淀,再加入盐酸沉淀不溶解
C.检验![]() :取样后加入氢氧化钠溶液,生成蓝色絮状沉淀
:取样后加入氢氧化钠溶液,生成蓝色絮状沉淀
D.检验![]() :取样后加入氢氧化钠溶液,产生使蓝色石蕊试纸变红色的气体
:取样后加入氢氧化钠溶液,产生使蓝色石蕊试纸变红色的气体
 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)2SO3(g) △H<0;
(1)写出该反应的化学平衡常数表达式K=__________
(2)降低温度,该反应K值__________,二氧化硫转化率___________,化学反应速率___________(以上均填增大、减小或不变)。
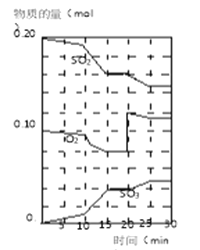
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态时间是___________________________。
(4)据图判断,反应进行至20min时,曲线发生变化的原因是_______________________(用文字表达)。
(5)10min到15min的曲线变化的原因可能是____________(填写编号)。
A、加了催化剂 B、缩小容器体积
C、降低温度 D、增加SO3的物质的量。
(6)若该反应的密闭容器为2L,则反应15min时,v(SO2)=___________
(7)为使该反应的反应速率增大,且平衡向正反应方向移动的是(____)
A、及时分离出SO3气体B、适当升高温度
C、增大O2的浓度 D、选择高效的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应2A(s)+3B(g) ![]() C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v(正)减小
③压强增大一倍,平衡不移动,v(正)、v(逆)不变
④增大B的浓度,v(正)>v(逆)
⑤加入催化剂,B的转化率提高
A.①②B.④C.③D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高中化学学习过程中的物质颜色是需要注意的。下列关于颜色的描述正确的个数是
①氯水放久了会逐渐由黄绿色变成几乎无色
②用硝酸银检验![]() 会产生AgBr难溶于水的白色沉淀
会产生AgBr难溶于水的白色沉淀
③KI溶液中加入淀粉溶液会变成蓝色
④溴水中加入![]() 振荡静置后,上层为橙红色
振荡静置后,上层为橙红色
⑤实验室的浓硝酸溶液久置呈黄色.
A.1个B.2个C.3个D.4个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如下图所示。分别滴加NaOH溶液(c=0.1 mol·L-1)至pH=7。消耗NaOH溶液的体积为Vx、Vy则( )
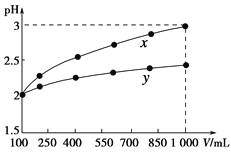
A.x为弱酸,Vx<VyB.x为强酸,Vx>Vy
C.y为弱酸,Vx<VyD.y为强酸,Vx>Vy
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烯烃A,分子式为C8H16,A在一定条件下被氧化只生成一种物质B。则符合上述条件的烃A有几种(考虑顺反异构)
已知: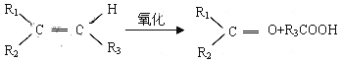
A. 3 B. 4 C. 6 D. 8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示装置中进行氨的催化氧化实验:往三颈瓶内的浓氨水中不断通入空气,将红热的铂丝插入瓶中并接近液面。反应过程中,可观察到瓶中有红棕色气体产生,铂丝始终保持红热。下列有关说法错误的是( )

A. 反应后溶液中含有NO3-
B. 反应后溶液中c(H+)增大
C. 实验过程中有化合反应发生
D. 实验过程中NH3H2O的电离常数不可能发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某研究性学习小组设计制取氯气并以氯气为反应物进行特定反应的装置

(1)要将C装置接入B和D之间,正确的接法是:a→________→________→ d 。
(2)实验开始先点燃A处的酒精灯,打开活塞K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C装置后进入D,D装置内盛有炭粉,发生氧化还原反应,生成CO2和HCl(g),发生反应的化学方程式为__________________________________________。为了使C装置发挥更好的作用,可向烧杯中加入浓硫酸,加入浓硫酸的作用是_________________________________________________________________。
(3) D处反应完毕后,关闭弹簧夹K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是_________________________________________________________,B的作用是______________________________________________________。
(4)A、B、C、D、E装置中有一处需要改进,说明需要改进的理由并在方框中画出改进后的装置图。
__________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
CuSO4和Cu(NO3)2是自然界中重要的铜盐。回答下列问题:
(1)CuSO4和Cu(NO3)2中阳离子基态核外电子排布式为____________,S、O、N三种元素的第一电离能由大到小为____________。
(2)SO42-的立体构型是________,与SO42-互为等电子体的一种分子为____________(填化学式)。
(3)往Cu(NO3)2溶液中通入足量NH3能生成配合物[Cu(NH3)4](NO3)2。其中NO3-中心原子的杂化轨道类型为________,[Cu(NH3)4](NO3)2中存在的化学键类型除了极性共价键外,还有____________。
(4)CuSO4的熔点为560℃,Cu(NO3)2的熔点为115℃,CuSO4熔点更高的原因是____________。
(5)利用CuSO4和NaOH制备的Cu(OH)2检验醛基时,生成红色的Cu2O,其晶胞结构如图所示。
①该晶胞原子坐标参数A为(0,0,0);B为(1,0,0);C为(![]() ,
,![]() ,
,![]() )。则D原子的坐标参数为________,它代表________原子。
)。则D原子的坐标参数为________,它代表________原子。
②若Cu2O晶体密度为d g·cm-3,晶胞参数为a pm,则阿伏加德罗常数值NA=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com