
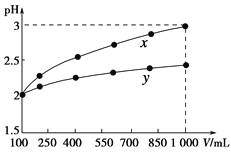
【题目】pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如下图所示。分别滴加NaOH溶液(c=0.1 mol·L-1)至pH=7。消耗NaOH溶液的体积为Vx、Vy则( )
A.x为弱酸,Vx<VyB.x为强酸,Vx>Vy
C.y为弱酸,Vx<VyD.y为强酸,Vx>Vy
【答案】C
【解析】
由图可知,pH=2的两种一元酸x和y,均稀释10倍,x的pH为3,y的pH<3,则x为强酸,y为弱酸;发生中和反应后pH=7,为中性,x与NaOH反应生成不水解的正盐,而y与NaOH反应生成水解显碱性的正盐,且酸的物质的量越大消耗NaOH越多,以此来解答。
由图可知,pH=2的两种一元酸x和y,均稀释10倍,x的pH为3,y的pH<3,则x为强酸,y为弱酸;pH=2的x,其浓度为0.01mol/L,与NaOH发生中和反应后pH=7,为中性,则0.01mol/L×0.1L=0.1mol/L×V碱,解得V碱=0.01L,而pH=2的y,其浓度大于0.01mol/L,若二者恰好生成正盐,水解显碱性,为保证溶液为中性,此时y剩余,但y的物质的量大于x,y消耗的碱溶液体积大,体积大于0.01L,则Vx<Vy;
故选:C。


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】二氧化硅晶体是立体的网状结构,其结构如图所示。
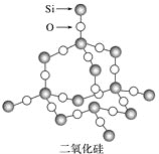
下列关于二氧化硅晶体网状结构的叙述正确的是
A. 存在四面体结构单元,O处于中心,Si处于4个顶角
B. 在最小的环上,有3个Si原子和3个O原子
C. 在最小的环上,Si和O的原子个数之比为1∶2
D. 在最小的环上,有6个Si原子和6个O原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲、乙、丙、X是四种中学化学中常见的物质,其转化关系如图所示.则甲和X不可能是( )

A. 甲为C,X为O2 B. 甲为SO2,X为NaOH溶液
C. 甲为Fe,X为Cl2 D. 甲为AlCl3,X为NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如图所示,提示:SiO2不与HCl反应。
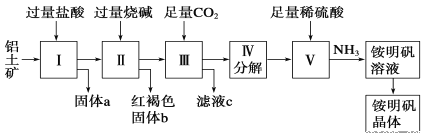
请回答下列问题:
(1)固体a的化学式为___。
(2)由图中Ⅱ所发生的离子方程式为___、___、___。Ⅲ所发生的离子方程式为___。
(3)从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)__、冷却结晶、过滤洗涤。
(4)以1000kg含氧化铝34%的铝土矿为原料制取Al2(SO4)3,需消耗质量分数为98%的硫酸(密度1.84g·cm-3)__L(保留一位小数)。
(5)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1:1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,0.1mol/L 的CH3COOH 溶液中有1% CH3COOH 分子发生电离,则溶液的pH=______________;可以使0.10mol·L-1 CH3COOH的电离程度增大的是____________。、
a.加入少量0.10 mol·L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010 mol·L-1. d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10 mol·L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH 均等于3 的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液有锌粉剩余,则生成氢气的体积:V( 盐酸)________V(醋酸)(填“>”、“ <” 或“=”)。
(3)0.1mol/L 的某酸H2A 的pH=4,则H2A 的电离方程式为_________________。
(4)某温度下,Kw=1×10-12,将0.02mol/L的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混和液的pH=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列九种物质:①H2 ②铝 ③Na2O2 ④CO2 ⑤H2SO4 ⑥Ba(OH)2固体 ⑦氨水 ⑧稀硝酸 ⑨熔融Al2(SO4)3
(1)按物质的分类方法填写表格的空白处:
分类标准 | 能导电 | 非电解质 | 电解质 |
属于该类的物质 | ___ | ___ | ___ |
(2)上述十种物质中有两种物质之间可发生离子反应:H++OH-=H2O,该离子反应对应的化学方程式为___。
(3)过量的⑦滴加到⑨的溶液中的离子方程式为___,34.2g⑨溶于水配成250mL溶液,SO42-的物质的量浓度为___。
(4)④与③充分反应的化学方程式为:___,当转移NA电子,生成标况下气体的体积为___。
(5)②与⑧发生反应的化学方程式为:Al+4HNO3=Al(NO3)3+NO↑+2H2O,该反应的氧化剂是___(填化学式),还原剂与氧化剂的物质的量之比是___,当有5.4gAl发生反应时,转移电子的物质的量为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源。科学家探究太阳能制氢技术,设计流程图如图:
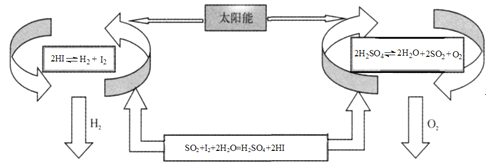
信息提示:以下反应均在150℃发生
2HI(aq)H2(g)+I2(g) △H1
SO2(g)+I2(g)+2H2O(g)=H2SO4(l)+2HI(g) △H2
2H2SO4(l)2H2O(g)+2SO2(g)+O2(g) △H3
2H2O(g)=2H2(g)+O2(g) △H4
请回答下列问题:
(1)△H4与△H1、△H2、△H3之间的关系是:△H4= ______ 。
(2)该制氢气技术的优点是 ______ ,若反应SO2(g)+I2(g)+2H2O(g)=H2SO4(l)+2HI(g)在150℃下能自发进行,则△H ______ 0(填“>”,“<”或“=”)。
(3)在某温度下,H2SO4在不同催化剂条件下分解产生氧气的量随时间变化如图所示,则下列说法正确的是 ______。
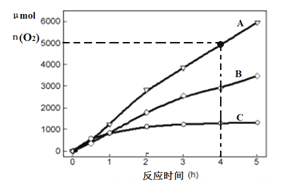
A H2SO4分解反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B 若在恒容绝热的密闭容器中发生反应,当K值不变时,说明该反应已经达到平衡
C 0~4小时在A催化剂作用下,H2SO4分解的平均速率v(O2)=1250molh-1
D 不同催化剂的催化效果不同,是因为活化分子百分数不相同
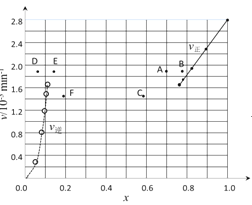
(4)对于反应:2HI(g)H2(g)+I2(g),在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数 K的计算式为: ______ 。
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为 ______ (以K和k正表示)。若k正=0.0027min-1,在t=40min时,v正= ______ min-1。
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为 ______ (填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁(FeC2O4)可作为生产电池正极材料磷酸铁锂的原料,受热容易分解,为探究草酸亚铁的热分解产物,按下面所示装置进行实验。
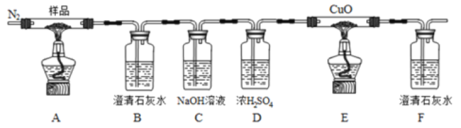
下列说法不正确的是
A.实验中观察到装置B、F中石灰水变浑浊,E中固体变为红色,则证明分解产物中有CO2和CO
B.反应结束后,取A中固体溶于稀硫酸,向其中滴加1~2滴KSCN溶液,溶液无颜色变化,证明分解产物中不含Fe2O3
C.装置C的作用是除去混合气中的CO2
D.反应结束后,应熄灭A,E处酒精灯后,持续通入N2直至温度恢复至室温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是一种重要的化工原料,下列有关说法正确的是( )
A.Na+、Fe3+、NO3-、Cl2都可在该物质的溶液中大量共存
B.向0.1mo1·L-1该物质的溶液中滴加0.1mol·L-1NaOH溶液,生成沉淀的物质的量与逐滴加入NaOH溶液体积关系如图所示
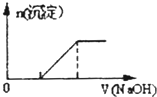
C.检验该物质中Fe2+是否变质的方法是向该物质的溶液中滴入几滴KSCN溶液,观察溶液是否变红色
D.向该物质的溶液中摘加Ba(OH)2溶液,恰好使SO42-完全沉淀的离子方程式为:Fe2++2SO42-+3Ba2++2OH-=2BaSO4↓+Fe(OH)2↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com