
【题目】铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如图所示,提示:SiO2不与HCl反应。
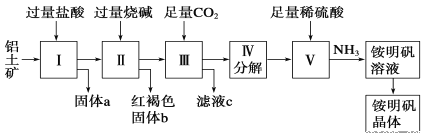
请回答下列问题:
(1)固体a的化学式为___。
(2)由图中Ⅱ所发生的离子方程式为___、___、___。Ⅲ所发生的离子方程式为___。
(3)从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)__、冷却结晶、过滤洗涤。
(4)以1000kg含氧化铝34%的铝土矿为原料制取Al2(SO4)3,需消耗质量分数为98%的硫酸(密度1.84g·cm-3)__L(保留一位小数)。
(5)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1:1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为___。
【答案】SiO2 Fe3++3OH-=Fe(OH)3↓ Al3++4OH-=AlO2-+2H2O H++OH-=H2O CO2+AlO2-+2H2O=Al(OH)3↓+HCO3- 蒸发浓缩 543.5 3:10
【解析】
(1) 铝土矿用盐酸溶解,Al2O3、Fe2O3反应得到AlCl3、FeCl3,SiO2不与盐酸反应,过滤得到固体a为SiO2,据此分析;
(2)滤液Ⅰ中含有AlCl3、FeCl3及剩余的HCl,再加入过量的烧碱,反应得到氢氧化铁沉淀、偏铝酸钠、氯化钠,过滤,红褐色沉淀b为氢氧化铁,溶液中含有偏铝酸钠、氯化钠及剩余的NaOH,通入过量的二氧化碳,反应生成氢氧化铝沉淀与碳酸氢钠,据此分析;
(3)从铵明矾溶液中获得铵明矾晶体的实验操作依次为蒸发浓缩、冷却结晶、过滤洗涤, 据此分析;
(4)根据Al2O3+3H2SO4=Al2(SO4)3+3H2O计算消耗溶质硫酸的质量,再计算需要硫酸溶液的质量,根据![]() 计算硫酸溶液的体积;
计算硫酸溶液的体积;
(5)设制得的Al2(SO4)3和NH4Al(SO4)212H2O的物质的量都是1 mol,根据Al3+和SO42-守恒计算。
(1)由上述分析可知,固体a的化学式为SiO2,故答案为:SiO2;
(2) 铝土矿用盐酸溶解,Al2O3、Fe2O3反应得到AlCl3、FeCl3,SiO2不与盐酸反应,过滤得到固体a为SiO2,滤液中含有AlCl3、FeCl3及剩余的HCl,再加入过量的烧碱,反应得到氢氧化铁沉淀、偏铝酸钠、氯化钠,过滤,红褐色沉淀b为氢氧化铁,溶液中含有偏铝酸钠、氯化钠及剩余的NaOH,通入过量的二氧化碳,反应生成氢氧化铝沉淀与碳酸氢钠,故答案为:Fe3++3OH-=Fe(OH)3↓;Al3++4OH-=AlO2-+2H2O;H++OH-=H2O;CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-;
(3)从铵明矾溶液中获得铵明矾晶体的实验操作依次为蒸发浓缩、冷却结晶、过滤洗涤, 故答案为:蒸发浓缩;
(4) m(Al2O3)=1000kg×34%=340kg,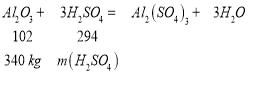 ,故
,故![]() ,需消耗质量分数98%的硫酸(密度1.84gcm3)为
,需消耗质量分数98%的硫酸(密度1.84gcm3)为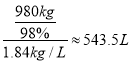 ,故答案为:543.5;
,故答案为:543.5;
(4)设制得的Al2(SO4)3和NH4Al(SO4)2·12H2O的物质的量都是1mol,则Al3+共3mol, SO42共5mol,根据Al3+和SO42守恒可得,加入Al2O3和H2SO4的物质的量之比为1.5:5=3:10,故答案为:3:10。


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:
【题目】近年来,由于石油价格不断上涨,以煤为原料制备一些化工产品的前景又被看好。下图是以烃A为原料生产人造羊毛的合成路线。

下列说法正确的是 ( )
A.合成人造羊毛的反应属于缩聚反应
B.A生成C的反应属于加成反应
C.A生成D的反应属于取代反应
D.烃A的结构简式为CH2===CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以某软锰矿(主要成分为MnO2,还含有SiO2、Al2O3等杂质)为原料,利用烟道气中的SO2制备MnSO4·H2O的流程如下:
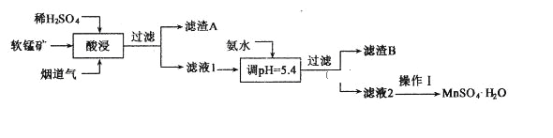
下列说法不正确的是
A. 滤渣A的主要成分能导电,可制备光导纤维
B. “酸浸”主要反应的离子方程式为MnO2+SO2=Mn2++SO42-
C. 加氨水调节pH的目的是除Al3+
D. 操作I为结晶、过滤、洗涤、干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,下列说法不正确的是( )
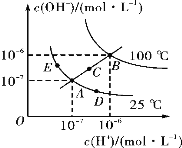
A.图中三点对应水电离出氢离子浓度关系:E<A<D
B.若从A点到E点,可采用温度不变,向水中加入适量的NaAc固体
C.图中三点对应离子积关系:B>C>A
D.当处在B点时,将pH=3的硫酸与pH=11的KOH溶液等体积混合后,溶液显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成气(CO+H2)广泛用于合成有机物,工业上常采用天然气与水蒸气反应等方法来制取合成气。
(1)在150℃时2L的密闭容器中,将2molCH4和2molH2O(g)混合,经过15min达到平衡,此时CH4的转化率为60%。回答下列问题:
①从反应开始至平衡,用氢气的变化量来表示该反应速率v(H2)=__。
②在该温度下,计算该反应的平衡常数K=__。
③下列选项中能表示该反应已达到平衡状态的是__。
A.v(H2)逆=3v(CO)正
B.密闭容器中混合气体的密度不变
C.密闭容器中总压强不变
D.C(CH4)=C(CO)
(2)合成气制甲醚的反应方程式为2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g) △H=bkJ/mol。有研究者在催化剂(Cu—Zn—Al—O和A12O3)、压强为5.OMPa的条件下,由H2和CO直接制备甲醚,结果如图所示。
CH3OCH3(g)+H2O(g) △H=bkJ/mol。有研究者在催化剂(Cu—Zn—Al—O和A12O3)、压强为5.OMPa的条件下,由H2和CO直接制备甲醚,结果如图所示。
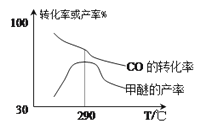
①290℃前,CO转化率和甲醚产率的变化趋势不一致的原因是__;
②b__0,(填“>”或“<”或“=”)理由是__。
(3)合成气中的氢气也用于合成氨气:N2+3H2![]() 2NH3。保持温度和体积不变,在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是__;
2NH3。保持温度和体积不变,在甲、乙、丙三个容器中建立平衡的相关信息如下表。则下列说法正确的是__;
A.n1=n2=3.2 B.φ甲=φ丙>φ乙 C.ν乙>ν丙>ν甲 D.P乙>P甲=P丙
容器 | 体积 | 起始物质 | 平衡时NH3的物质的量 | 平衡时N2的 体积分数 | 反应开始时的速率 | 平衡时容器内压强 |
甲 | 1L | 1molN2+3molH2 | 1.6mol | φ甲 | ν甲 | P甲 |
乙 | 1L | 2molN2+6molH2 | n1mol | φ乙 | ν乙 | P乙 |
丙 | 2L | 2molN2+6molH2 | n2mol | φ丙 | ν丙 | P丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如下图所示。分别滴加NaOH溶液(c=0.1 mol·L-1)至pH=7。消耗NaOH溶液的体积为Vx、Vy则( )
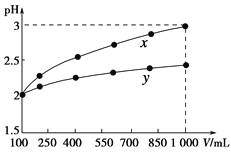
A.x为弱酸,Vx<VyB.x为强酸,Vx>Vy
C.y为弱酸,Vx<VyD.y为强酸,Vx>Vy
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某物质由铁和氧两种元素组成,实验测得铁元素与氧元素的质量比为21∶8,关于该物质的下列说法中不正确的是( )
A.铁元素与氧元素物质的量比为3∶4
B.该物质可能为四氧化三铁
C.该物质一定为四氧化三铁
D.该物质可能为混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.除去苯中的杂质苯酚可加入浓溴水后过滤
B.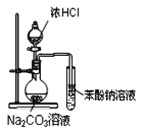 装置可证明酸性:盐酸>碳酸>苯酚
装置可证明酸性:盐酸>碳酸>苯酚
C.乙二酸与足量的酸性KMnO4溶液混合:5H2C2O4 + 2MnO4- + 6H+ =10CO2 ↑ + 2Mn2+ + 8H2O
D.鉴别![]() 和
和![]() 只能用金属钠
只能用金属钠
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com