
【题目】用水稀释0.1mol·L-1氨水,溶液中随着水量的增加而增大的是( )
A.![]()
B.![]()
C.![]()
D.c(H+)·c(OH-)
【答案】C
【解析】
用水稀释0.1mol/L氨水时,溶液中随着水量的增加,NH3H2OOH-+NH4+平衡正向移动,n(OH-)增大,但溶液的体积增大的多,则c(OH-)减小,由于水的离子积不变,则溶液中氢离子浓度最大,据此分析解答。
A.溶液中存在平衡:NH3H2OOH-+NH4+,加水稀释,促进电离平衡正向移动, n(NH3H2O)减小,n(NH4+)增大,则![]() 减小,故A错误;
减小,故A错误;
B.溶液中存在平衡:NH3H2OOH-+NH4+,一水合氨的电离平衡常数为:Kb=![]() ,温度不变,则一水合氨的电离平衡常数不变,故B错误;
,温度不变,则一水合氨的电离平衡常数不变,故B错误;
C.稀释过程中,氢氧根离子浓度减小,而水的离子积不变,则氢离子浓度最大,所以![]() 的比值增大,故C正确;
的比值增大,故C正确;
D.水的离子积为Kw=c(H+)c(OH-),温度不变,则水的离子积不变,故D错误;
故选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列说法中正确的是( )
A.含0.1molBaCl2的溶液中Cl-数为0.1NA
B.22gCO2所含有的分子数为0.5NA
C.11.2LCO2所含有的分子数为0.5NA
D.标准状况下1mol乙醇分子所占有的体积为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需配制0.10 mol·L-1 NaCl溶液250 mL。
(1)容量瓶上需要标有_________。
①温度 ②浓度 ③容量 ④压强 ⑤刻度线 ⑥酸(碱)式
(2)按下列操作步骤填上适当的文字,以使整个操作完整。
第一步:选择仪器。完成本实验所必需的仪器有:
天平(精确到0.1 g)、药匙、_____、_____、_____、_____以及等质量的两片纸。
第二步:计算。配制该溶液需取NaCl晶体______g。
第三步:称量。
①天平调平之后,应将天平的游标调至某个位置,请在下图中用一根竖线标出游码左边缘所处的位置:______
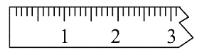
②称量过程中NaCl晶体应放于天平的________(填“左盘”或“右盘”)。
③称量完毕,将药品倒入________中。
第四步:__________,该步实验中还需进行的动手操作是: _________________________________
第五步:转移、洗涤。
第六步:_____________________________________。
第七步: ____________________________________。
第八步:将配好的溶液静置一段时间后,倒入指定的试剂瓶,并贴好标签,注明配制的时间、名称及浓度。
(3)定容摇匀后,某同学发现液面略低于刻度线,又用蒸馏水添加至刻度线。该操作是否会对所配制的溶液浓度造成影响?为什么?_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:实验一:焦亚硫酸钠的制取采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置Ⅱ中有Na2S2O5晶体析出,发生的反应为Na2SO3+SO2=Na2S2O5。
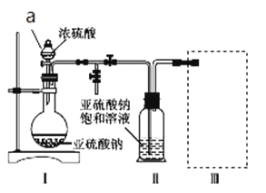
(1)加试剂前要进行的操作是__。装置Ⅰ中产生气体的化学方程式为__。
(2)从装置Ⅱ中分离出产品可采取的分离方法是__。
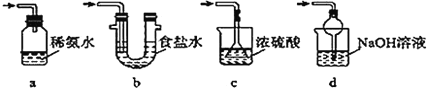
(3)为了完整实验装置,在下列装置中选择一个最合理的装置放在装置Ⅲ处,可选用的装置(夹持仪器已略去)为__(填序号)。
实验二:葡萄酒中抗氧化剂残留量的测定
(4)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如图:
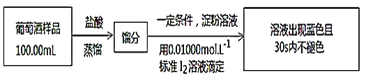
(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液30.00mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为__g·L-1。
②若实验过程中有部分HI被空气氧化,则测定结果__(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如图所示,提示:SiO2不与HCl反应。
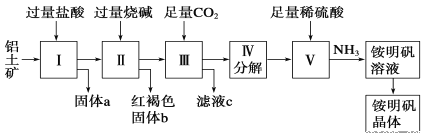
请回答下列问题:
(1)固体a的化学式为___。
(2)由图中Ⅱ所发生的离子方程式为___、___、___。Ⅲ所发生的离子方程式为___。
(3)从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)__、冷却结晶、过滤洗涤。
(4)以1000kg含氧化铝34%的铝土矿为原料制取Al2(SO4)3,需消耗质量分数为98%的硫酸(密度1.84g·cm-3)__L(保留一位小数)。
(5)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1:1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2Fe2++Cl2=2Cl﹣+2Fe3+,2Br﹣+Cl2=Br2+2Cl﹣,2Fe2++Br2=2Br﹣+2Fe3+。在bL FeBr2溶液中通入amol Cl2时,使溶液中50% 的Br﹣氧化为Br2,则原FeBr2的物质的量浓度为
A. a/bmolL﹣1 B. 2a/bmolL﹣1 C. 3a/bmolL﹣1 D. 5a/bmolL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列九种物质:①H2 ②铝 ③Na2O2 ④CO2 ⑤H2SO4 ⑥Ba(OH)2固体 ⑦氨水 ⑧稀硝酸 ⑨熔融Al2(SO4)3
(1)按物质的分类方法填写表格的空白处:
分类标准 | 能导电 | 非电解质 | 电解质 |
属于该类的物质 | ___ | ___ | ___ |
(2)上述十种物质中有两种物质之间可发生离子反应:H++OH-=H2O,该离子反应对应的化学方程式为___。
(3)过量的⑦滴加到⑨的溶液中的离子方程式为___,34.2g⑨溶于水配成250mL溶液,SO42-的物质的量浓度为___。
(4)④与③充分反应的化学方程式为:___,当转移NA电子,生成标况下气体的体积为___。
(5)②与⑧发生反应的化学方程式为:Al+4HNO3=Al(NO3)3+NO↑+2H2O,该反应的氧化剂是___(填化学式),还原剂与氧化剂的物质的量之比是___,当有5.4gAl发生反应时,转移电子的物质的量为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实中,不能用勒夏特列原理解释的是
A.将混合气体中的氨液化有利于合成氨反应
B.对CO(g)+NO2(g)![]() CO2(g)+NO(g)平衡体系增大压强可使其颜色变深
CO2(g)+NO(g)平衡体系增大压强可使其颜色变深
C.常温下,将1mLpH=3的醋酸溶液加水稀释到100mL,测得其pH<5
D.实验室中常用排饱和食盐水的方法收集氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请完成下列问题:
(1)写出由乙醇制取乙二酸的反应方程式_________。
(2)相对分子质量为72且沸点最低的烷烃的习惯名称是__________。
(3)用系统命名法命名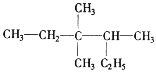 _____。
_____。
(4)某烯烃分子式为C6H12,其同分异构体中主链为4个碳原子的有______种。
(5)合成高聚物![]() 其单体的键线式_______。
其单体的键线式_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com