
【题目】(Ⅰ)如图为一“铁链”图案,小明在图案上分别写了H2、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分A、B、C、D为其相应的分类依据代号。请回答下列问题:

(1)请将分类依据代号填入相应的括号内:
_______两种物质都不是电解质
_______两种物质都是盐
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入饱和的图中某种物质M的溶液加热至呈红褐色。
①物质M的化学式为_____。
②涉及到的化学方程式是____。
③证明有红褐色胶体生成的实验操作是_____。
(Ⅱ)反应:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,还原剂与氧化剂的物质的量之比:___,当有0.6mol电子转移时。生成的NO在标准状况的体积为____L。
【答案】A D FeCl3 FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl 用一束光照射烧杯中的物质,若能产生丁达尔效应,则证明生成了Fe(OH)3胶体 3:2 4.48
Fe(OH)3(胶体)+3HCl 用一束光照射烧杯中的物质,若能产生丁达尔效应,则证明生成了Fe(OH)3胶体 3:2 4.48
【解析】
(Ⅰ)(1)氢气为单质,不是电解质;二氧化碳为氧化物,与水反应后所得的溶液可电离出离子可导电,但不是自身电离,不是电解质;氧化钠为氧化物,在熔融状态下可导电,属于电解质;氯化钠属于盐,其水溶液可导电,属于电解质;氯化铁属于盐,其水溶液可导电,属于电解质;则都不是电解质的为A,都属于盐的为D,
故答案为:A;D;
(2)①氢氧化铁胶体的制备的化学方程式:FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl,物质M为FeCl3,
Fe(OH)3(胶体)+3HCl,物质M为FeCl3,
故答案为:FeCl3;
②涉及到的化学方程式是FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl
Fe(OH)3(胶体)+3HCl
答案为:FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl;
Fe(OH)3(胶体)+3HCl;
③胶体具有丁达尔效应,可以利用此性质检验胶体,方法为:用一束光照射烧杯中的液体,若能产生丁达尔效应,则证明生成了Fe(OH)3胶体,
故答案为:用一束光照射烧杯中的液体,若能产生丁达尔效应,则证明生成了Fe(OH)3胶体;
(3)由铜和硝酸反应的离子方程式可知:3Cu+8H++2NO3═3Cu2++2NO↑+4H2O,化合价降低元素的N元素所在的反应物HNO3是氧化剂,对应的产物NO是还原产物,化合价升高元素的Cu元素所在的反应物Cu是还原剂,Cu(NO3)2是氧化产物,在参加反应的8mol硝酸中,被还原的硝酸的物质的量为2mol,反应中还原剂与氧化剂的物质的量之比为3:2;生成NO的物质的量是2mol,转移电子是6mol,若反应中转移了0.6mol电子,产生的气体的物质的量是0.2mol,在标准状况下的体积是0.2mol×22.4L/mol=4.48L,
故答案为:3:2;4.48。


科目:高中化学 来源: 题型:
【题目】电解法处理CO2和SO2混合污染气的原理如下图所示,电解质为熔融碳酸盐和硫酸盐,通电一段时间后,Ni电极表面形成掺杂硫的碳积层。下列说法错误的是

A. Ni电极表面发生了还原反应
B. 阳极的电极反应为:2O2—-4e-=O2
C. 电解质中发生的离子反应有:2SO2 +4O2—=2SO42—
D. 该过程实现了电解质中碳酸盐和硫酸盐的自补充循环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g)C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题

(1)图中该反应是________________反应(填“吸热”或“放热”),反应热△H的表达式为_________________
(2)当反应达到平衡时,升高温度,A的转化率_________________(填“增大”“减小”或“不变”)。
(3)在反应体系中加入催化剂,E1和E2的变化是:E1________________________,E2________________(填“增大’“减小”或“不变”),化学_________________平衡移动(填“向左”、“向右”或“不”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)某化学兴趣小组设计了图示实验装置(图中省略了夹持仪器)来测定某铁碳合金中铁的质量分数。
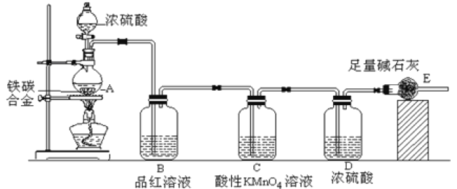
(1)仪器A的名称是___________。
(2)C装置的作用______________。
(3)该小组同学设计的实验装置存在缺陷,有关该实验装置及实验过程中,下列因素可能会导致铁质量分数测量值偏低的是___________。
A.A中反应不完全
B.反应生成的SO2部分被E中碱石灰吸收
C.E中碱石灰会吸收空气中的CO2和H2O
D.反应完全后,还有CO2气体滞留在装置体系中
(二)将19.20 g CuO和Fe2O3的混合物在高温下与足量的CO充分反应,反应后全部气体用200 mL 1.20 molL-1 Ba(OH)2溶液吸收,生成35.46 g白色沉淀(不考虑沉淀的溶解,忽略溶液体积的变化)。
(4)则吸收气体后溶液中溶质的化学式为________,其浓度为_________。
(5)混合物中CuO和Fe2O3的物质的量之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A(g)+B(g)![]() C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
830℃时,向一个2L的密闭容器中充入0.2mol的A和0.8mol的B,反应初始4s内A的平均反应速率v(A)=0.005 mol/(L·s)。下列说法正确的是
A. 4s时c(B)为0.78 mol/L
B. 该反应AH>0
C. 830℃达平衡时,A的转化率为20%
D. 1200℃时反应C(g)+D(g)![]() A(g)+B(g)的平衡常数为2.5
A(g)+B(g)的平衡常数为2.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈_______(填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+) ____________c(CH3COO-)(填“ >”或“=”或“<” )。
(2)常温下,取0.2 mol/L HCl溶液与0.2mol/L MOH溶液等体积混合,测得混合后溶液的pH=5。写出MOH的电离方程式:__________________。
(3) 99 ℃时,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH=2。此时水的离子积Kw=________,水电离出的c(H+)=________,而此时溶液中的c(Na+)__________ c(SO42-)(填“>”“=”或“<”)。
(4)相同温度下等物质的量浓度的下列溶液中
A.NH4C1 B.NH4HCO3 C.NH4HSO4 D.(NH4)2SO4
①pH值由大到小的顺序是__________(用对应的字母填写)。
②NH4+离子浓度由大到小的顺序是__________(用对应的字母填写)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是:( )
①金属钠、氢气都能在氯气中燃烧,生成白色的烟雾;②铜丝在氯气中燃烧,生成蓝绿色的氯化铜;③液氯就是氯气的水溶液,它能使干燥的有色布条褪色;④久置的氯水,因氯气几乎完全挥发掉,剩下的就是水
A.①B.①②C.①③④D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】认真分析物质的量浓度的概念及其定义式并思考,下列溶液中溶质的物质的量浓度为1mol·L-1的是( )
A. 将40gNaOH溶解于1L水中
B. 将22.4L氯化氢气体溶于水配成1L溶液
C. 将1L10 mol·L-1的浓盐酸与9L水混合
D. 将10gNaOH溶解于水中配成250mL溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)是一种过渡金属元素,通常用作合金及不锈钢的添加剂。钼酸钠晶体(Na2MoO4·2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是MoS2,含少量的PbS等)制备钼酸钠晶体的主要流程如图所示:

(1)Na2MoO4·2H2O中钼元素的化合价是___________。结晶得到的是钼酸钠晶体的粗产品,要得到纯净的钼酸钠晶体,还需要进行的操作是___________(填名称)。
(2)焙烧过程中钼精矿发生的主要化学反应方程式为MoS2+O2-MoO3+SO2(未配平),该反应中氧化产物是___________。
(3)写出“碱浸”反应的离子方程式:_____。为了能提高该反应速率,可采取的措施有_____。
(4)碱浸液结晶前需加入Ba(OH)2固体以除去SO42-。当BaMoO4开始沉淀时,SO42-的去除率是____________%[已知:碱浸液中c(MoO42-)=0.40mol·L-1,c(SO42-)=0.04mol·L-1,Ksp(BaSO4)=1.1×10-10、Ksp( BaMoO4)=4.0×10-8,加入Ba(OH)2固体引起的溶液体积变化可忽略。]
(5)如图是碳钢在盐酸、硫酸和钼酸钠-月桂酰肌氨酸缓释剂3种不同介质中腐蚀速率的实验结果:

①碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是___________。
②空气中缓释剂对碳钢的缓蚀原理是在钢铁表面形成 FeMoO4-Fe2O3保护膜。密闭式循环冷却水系统中的碳钢管道缓蚀除需加入缓释剂外还需加入NaNO2,NaNO2的作用是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com