
| n |
| v |
| n |
| v |
| n |
| v |


科目:高中化学 来源: 题型:
| Kw |
| c(H+) |
| A、(2)(3)(4) |
| B、(4)(7) |
| C、(3)(4)(8) |
| D、(1)(5)(6) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 有关问题 |
| (1)计算所需浓H2SO4体积为(保留一位小数) | 需要浓H2SO4体积为 |
| (2)量取浓H2SO4 | 用 |
| (3)在100mL烧杯中稀释浓H2SO4 | 向盛有一定量水的烧杯中沿烧杯内壁慢慢倒入浓H2SO4,并不断搅拌.冷却到室温. |
| (4)将烧杯中的溶液转移至 | |
| (5)并用少量的水洗涤烧杯内壁2~3次,洗涤液也都注入容量瓶. | (8)出现如下情况,对所配溶液浓度有何影响?(填“偏低”、“偏高”或“无影响”) ①没有进行操作步骤(5) ②在第(4)步不慎有少量液体流到容量瓶外 ③容量瓶没干燥,内壁附有少量蒸馏水 ④在定容观察液面时,俯视刻度线 |
| (6)轻轻摇匀容量瓶,使溶液混合均匀 | |
| (7)将蒸馏水注入容量瓶,液面离容量瓶刻度线下1~2cm时,改用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
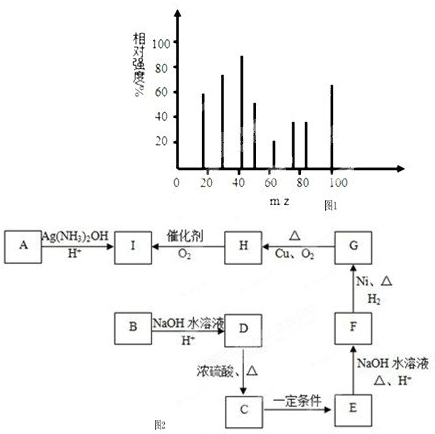
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com