
【题目】NaHCO3在潮湿的空气中会缓慢分解,Na2CO3会吸收空气中的水分:Na2CO3+nH2O=Na2CO3·nH2O(n为平均值,n≤10)。取没有妥善保管已部分变质的一定质量的NaHCO3样品溶于水配成溶液,慢慢滴入稀盐酸并不停地搅拌,加入盐酸的体积与生成的CO2的体积(标准状况)如下表。(不计溶于水的CO2气体)

试求:
(1)该盐酸溶液的物质的量浓度为_______mol·L-1。
(2)未变质前NaHCO3的物质的量为 ________mol。
【答案】 2 mol·L-1 0.22 mol
【解析】试题分析 (1)根据碳酸钠与盐酸反应的过程是![]() ,开始产生气体时的反应为
,开始产生气体时的反应为![]() ,根据表格数据可知,加入5mL盐酸放出224mL气体计算盐酸的浓度; (2)根据钠元素守恒计算NaHCO3的物质的量。
,根据表格数据可知,加入5mL盐酸放出224mL气体计算盐酸的浓度; (2)根据钠元素守恒计算NaHCO3的物质的量。
解析: (2)设盐酸的浓度为c mol·L-1,
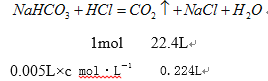
![]() ,c=2 mol·L-1;
,c=2 mol·L-1;
(2) 根据表格数据,溶液中n(CO32-)+n(HCO3-)=![]() 0.2mol,
0.2mol,
用于将CO32-转变为HCO3-消耗HCl的体积为10mL,物质的量为10×10-3L×2.0mol/L=0.02mol;故n(Na2CO3)=0.02mol 、n(NaHCO3)=0.2mol-0.02mol=0.18mol,则钠元素的物质的量为0.18mol+0.02mol×2=0.22mol,根据钠元素守恒计算NaHCO3的物质的量为0.22mol。
解析:碳酸钠与盐酸的反应分2步进行,先生成碳酸氢钠,后碳酸氢钠与盐酸反应生成二氧化碳气体。


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
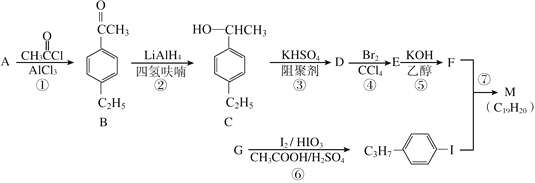
【题目】化合物M是二苯乙炔类液晶材料的一种,最简单的二苯乙炔类化合物是![]() 。以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
。以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
回答下列问题:
(1)A的结构简式为________。
(2)D分子中最多有________个碳原子共平面。
(3)①的反应类型是________,④的反应类型是________。
(4)⑤的化学方程式为____________________________________________。
(5)B的同分异构体中能同时满足如下条件:①苯环上有两个取代基,②能发生银镜反应,共有________种(不考虑立体异构),其中核磁共振氢谱为5组峰,且峰面积比为6:2:2:1:1的是________(写结构简式)。
(6)参照上述合成路线,设计一条由苯乙烯和甲苯为起始原料制备![]() 的合成路线:___________________________________。
的合成路线:___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、环境密切相关,下列有关说法错误的是
A. 夏季游泳场馆的池水可加少量漂白粉消毒 B. 用可燃冰替代燃煤作燃料可减少大气污染
C. 向海水中加入明矾可以使海水淡化 D. 石墨烯锂离子电池比镍氢电池的能量密度更高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用钛白工业的副产品FeSO4(含Al2(SO4)3和少量重金属离子)可以生产电池级高纯超微细草酸亚铁。其工艺流程如下:

已知:①5Fe2++ MnO4-+8H+=5Fe3++Mn2++4H2O
5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O
(1)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有 。
(2)滤液经处理可得到副产品 。
(3)实验室测定高纯超微细草酸亚铁组成的步骤依次为:
步骤1:准确称量一定量草酸亚铁样品,加入25 mL 2 mol·L-1的H2SO4溶解。
步骤2:用0.2000 mol·L-1标准KMnO4溶液滴定,消耗其体积30.40 mL。
步骤3:向滴定后的溶液中加入2 g Zn粉和5 mL 2 mol·L-1的H2SO4溶液,将Fe3+还原为Fe2+。
步骤4:过滤,滤液用上述标准KMnO4溶液滴定,消耗溶液10.00 mL。
则样品中C2O42-的物质的量为 。(写出计算过程)
(4)将一定量高锰酸钾溶液与酸化的草酸亚铁溶液混合,测得反应 液中Mn2+的浓度随反应时间t的变化如图,其变化趋势的原因可能为 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.![]() 的系统命名法为2,5-二甲基-4-乙基己烷
的系统命名法为2,5-二甲基-4-乙基己烷
B.石油的裂化、煤的气化与液化都属于化学变化,而石油的分馏与煤的干馏都属于物理变化
C.总质量一定时,乙酸和葡萄糖无论以何种比例混合,完全燃烧消耗氧气的量相等
D.油脂、淀粉、蛋白质等高分子化合物都属于混合物,一定条件下均可发生水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关甲烷的说法不正确的是( )
A. 甲烷分子中四个碳氢键键长相等
B. 甲烷分子中四个碳氢键键角相等
C. 甲烷分子中四个碳氢键键能相等
D. 由于甲烷分子三个键参数都分别相等,所以甲烷的空间构型是平面正方形结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】尿素[CO(NH2)2]是首个由无机物人工合成的有机物。
(1)工业上用CO2和NH3在一定条件下合成,其反应方程式__________。
(2)在一个2L的密闭容器内,当起始投入量氨碳比![]() =4,CO2的转化率随时间的变化关系如下图所示。
=4,CO2的转化率随时间的变化关系如下图所示。
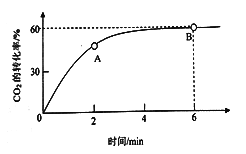
① A点的逆反应速率v逆(CO2) __________________B点的正反应速率为v正(CO2)(填“大于”、“小于”或“等于”)
②假设氨的起始投入量为8mol,求从开始到达到平衡状态这段时间内v(NH3)=_________________。
③NH3的平衡转化率为____________________。
④单纯从制备的成本角度考虑,我们希望氨碳比![]() 尽可能__________(“大”、“小”)因为_________。
尽可能__________(“大”、“小”)因为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com