
【题目】【化学——选修物质结构与性质】主族元素碳、氧、氮、氟、磷、硒及副族元素镍、铜元素在化学中有很重要的地位,回答下列问题:
(1)在基态14C原子中,核外存在 对自旋相反的电子,基态氮原子的价层电子排布图为_________________________。
(2)将F2通入稀NaOH溶液中可生成OF2,OF2分子构型为 ,其中氧原子的杂化方式为 。
(3)过渡金属配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n= 。CO与N2结构相似,CO分子内σ键与π键个数之比为 。
(4)CuSO4溶液能用作P4中毒的解毒剂,反应可生成P的最高价含氧酸和铜,该反应的化学方程式是 。
(5)H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释H2SeO4比H2SeO3酸性强的原因: ;
(6)已知Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有 个铜原子。
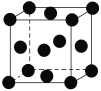
(7)用晶体的X射线衍射法对Cu的测定得到以下结果:Cu的晶胞为面心立方最密堆积(如右图),已知该晶体的密度为9.00 g·cm-3,Cu的原子半径为________cm(阿伏加德罗常数为NA,只要求列式表示)。
【答案】(1) 2 (1分)![]() (1分)
(1分)
(2)V形(1分) sp3(1分) (3)4(2分) 1∶2(1分)
(4)P4+10CuSO4+16H2O=10Cu+4H3PO4+10H2SO4。(2分)
(5)H2SeO3中的Se为+4价,而H2SeO4中的Se为+6价,正电性更高,导致Se—O—H中O的电子更向Se偏移,越易电离出H+(2分)
(6) 16 (2分) (7)![]() ×
×![]() (2分)
(2分)
【解析】
试题分析:(1)14C原子核外电子排布为1s22s22p2,核外存在2对自旋相反的电子,其基态原子的价电子排布图为![]() ;
;
(2)OF2分子中O原子的价层电子对数=2+(6-2×1)×1/2=4,则O原子的杂化类型为sp3杂化,V形结构;
(3)Ni的价电子数为10,每个配体提供一个电子对,则10+2n=18,故n=4,CO与N2结构相似,含有C≡O键,含有1个σ键,2个π键,CO分子内σ键与π键个数之比为1:2;
(4)CuSO4溶液能用作P4中毒的解毒剂,反应生成磷酸和铜,该反应的化学方程式是:P4+10CuSO4+16H2O=10Cu+4H3PO4+10H2SO4;
(5)H2SeO3的分子结构为![]() ,Se为+4价,而H2SeO4的分子结构为
,Se为+4价,而H2SeO4的分子结构为![]() ,Se为+6价,后者Se原子吸电子能力强,导致Se-O-H中的O原子更向Se偏移,则羟基上氢原子更容易电离出H+;
,Se为+6价,后者Se原子吸电子能力强,导致Se-O-H中的O原子更向Se偏移,则羟基上氢原子更容易电离出H+;
(6)该晶胞中O原子数为4×1+6×1/2+8×1/8=8,由Cu2O中Cu和O的比例可知该晶胞中铜原子数为O原子数的2倍,即为16个;
(7)Cu的晶胞为面心立方最密堆积,以顶点Cu原子研究,与之最近的Cu原子位于面心上,每个顶点Cu原子为12个面共用,所以Cu的配位数为12,根据晶胞的结构图可知,晶胞中含有铜原子数为8×1/8+6×1/2=4,设晶胞的边长为a cm,则a3ρNA=4×64,所以a=![]() ,由于面对角线为
,由于面对角线为![]() a,面对角线的1/4为Cu原子半径,所以Cu原子半径为
a,面对角线的1/4为Cu原子半径,所以Cu原子半径为![]() ×
×![]() cm。
cm。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】关于明矾的下列说法错误的是( )
A.明矾的化学式为KAl(SO4)2
B.明矾是纯净物
C.明矾可用于净水
D.明矾中存在K+和Al3+两种阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,将amol/L的氨水与0.01mol/L的HCl溶液等体积混合,反应后溶液呈中性,下列说法不正确的是(忽略溶液混合后体积的变化)
A.溶液中c(NH4+)=c(Cl-)
B.此时水的电离程度最大
C.此时溶液中NH3·H2O的物质的量浓度为1/2[(a-0.01)]mol/L
D.用含a 的代数式 NH3·H2O的电离平衡常数Kb=![]() (mol/L)
(mol/L)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.自发反应的熵一定增大,非自发反应的熵一定减小
B.凡是放热反应都是自发的,因为吸热反应都是非自发的
C.反应2Mg(s)+CO2(g)=C(s)+2MgO(s)能自发进行,则该反应的ΔH>0
D.常温下,反应C(s)+CO2(g)![]() 2CO(g)不能自发进行,则该反应的ΔH>0
2CO(g)不能自发进行,则该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于同温同压下等体积的CO2和CO的叙述:①质量相等②密度相等③所含分子数相等④所含碳原子数相等。其中正确的是
A.①②③④
B.②③④
C.③④
D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铝的叙述中,不正确的是( )
A.铝是地壳里含量最多的金属元素
B.铝容易失去电子,表现还原性
C.在空气中用酒精灯点不着
D.在常温下,铝不能与氧气反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若mgNa在足量氯气中燃烧,生成固体的质量为(m+3.55)g,则mgNa与氧气反应,生成固体的质量为( )
①(m+0.8)g ②(m+1.0)g ③(m+1.2)g④(m+1.6)g ⑤(m+1.4)g
A.①④
B.①⑤
C.③④
D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。该电池是以K2FeO4和Zn为电极材料,KOH溶液为电解溶质溶液,其总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH,下列说法正确的是
3Zn(OH)2+2Fe(OH)3+4KOH,下列说法正确的是
A.Zn为电池的正极
B.充电时阳极反应为:Fe(OH)3-3e+5OH =FeO42-+4H2O
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D.该电池放电过程中电解质溶液浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】长征2号火箭承担运载“神六”的使命,氕化锂、氘化锂、氚化锂可以作为启动长征2号(CZ2F)火箭的优良炸药。下列说法正确的是
A. LiH、LiD、LiT的摩尔质量之比为1∶2∶3 B. 它们都是强还原剂
C. H、D、T之间互称为同素异形体 D. 它们都是强氧化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com