
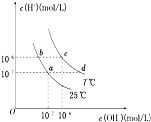
| A、a点对应的溶液中大量存在:Fe3+、Na+、Cl-、SO42- |
| B、b点对应的溶液中大量存在:NH4+、Ba2+、ClO-、I- |
| C、c点对应的溶液中大量存在:Na+、Ba2+、Cl-、CO32- |
| D、d点对应的溶液中大量存在:Na+、K+、SO32-、Cl- |


 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、p区元素全部都是主族元素 |
| B、稀有气体的原子的电子排布最外层都是以p6结束 |
| C、主族元素的原子核外电子最后填入的能级是s能级或p能级 |
| D、核外电子排布相同的微粒,一定具有相同的化学性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
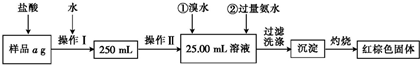
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+(g)+Cl-(g)═NaCl(s);△H | ||
B、Na(s)+
| ||
| C、Na(s)═Na(g);△H2 | ||
| D、Na(g)-e-═Na+ (g);△H |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 10℃ | 20℃ | 30℃ |
| 溶解度(g/100g H2O) | 2.5 | 3.9 | 5.6 |
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀. | |
| 步骤2:取适量滤液于试管中,滴加稀硫酸. | ①若出现 |
| 步骤3:取适量步骤1中的沉淀于试管中,滴加盐酸,连接带塞导气管将产生的气体导入澄清石灰水. | ②若出现 |
| 步骤4:取步骤1中的滤液于烧杯中,用pH计测定其pH. | ③若pH_ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相 关 信 息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | Y元素的激发态原子的电子排布式为1s22s22p63s23p34s1 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在2L容器中有3种物质进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t时刻达到平衡
在2L容器中有3种物质进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t时刻达到平衡查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com