


科目:高中化学 来源: 题型:
| A、硫酸、纯碱、碳酸钠和生石灰分别属于酸、碱、盐和氧化物 |
| B、生石灰与水混合的过程只发生物理变化 |
| C、可用丁达尔效应区分溶液与胶体 |
| D、CuSO4?5H2O是一种混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 7 |
| 8 |
| X | Y | |
| Z | W |
| A、Y单质可与Z的氢化物的水溶液反应,使溶液pH升高 |
| B、含氧酸的酸性:W>Z |
| C、原子半径由大到小的排列顺序是Z>Y>X |
| D、X的单质中有一种为白色蜡状固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 实现现象 | 反应的离子方程式 |
| 往滤渣中加入过量NaOH溶液. |  | ① |
| 过滤,往所得滤液中通入过量二氧化碳, | ② | ③ |
| 继续加入过量稀盐酸 | ④ |  |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
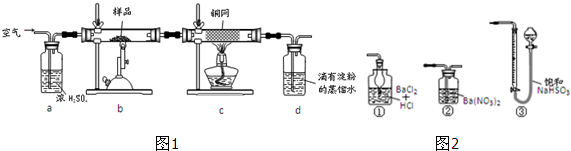
| 1 |
| 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
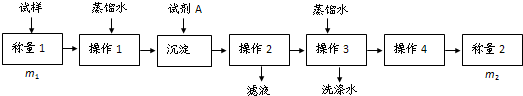
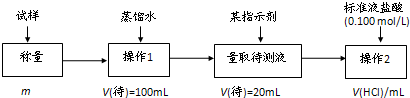
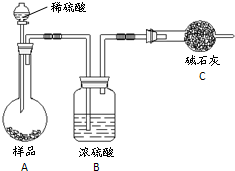
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com