
A��B��C����ǿ����ʣ�������ˮ�е�������������±���ʾ��
| ������ | Ag+ Na+ |
| ������ | NO3- SO42- Cl- |
��ͼ��ʾװ���У��ס��ҡ��������ձ����ηֱ�ʢ��������A��B��C������Һ���缫��Ϊʯī�缫��

��ͨ��Դ������һ��ʱ��������c�缫����������27�ˡ������¸��ձ�����Һ��pH����ʱ��t�Ĺ�ϵͼ���ϡ��ݴ˻ش��������⣺
��1��MΪ��Դ�� ������д���������������ס��ҵ���ʷֱ�Ϊ �� ����д��ѧʽ����
��2��Ҫʹ���������Һ�ָ���ԭ����״̬��Ӧ���� ���ʡ�����д��ѧʽ��
��3�� ���������Һ�����Ϊ25L���Ҳ���������ȫ���ݳ�������Һ����ʱ��pHΪ ��
��4��д�����ձ��з�����Ӧ�����ӷ���ʽ
��5��д�����ձ��з�����Ӧ�����ӷ���ʽ
��֪ʶ�㡿��� ���ӷ���ʽ����д B1 F4
���𰸽�������1������NaCl��AgNO3
��2��H2O��ˮ��3��12
(4) 4 Ag+ + 2H2O  4 Ag+O2��+ 4 H+
4 Ag+O2��+ 4 H+
2Cl-+2H2O===Cl2��+H2��+2OH-
��������1����ΪAg+����SO42- ��Cl-�������ӷ�Ӧ�������������ܹ��棬����ֻ����AgNO3��Һ������������ֵ������Һ�ֱ���Na2SO4��NaCl��Һ����������������Һ����Ϊ���������ƣ���SO42- ��Cl-��Ȼ��һ��û���γ����ʡ����ݸ��ձ�����Һ��pH����ʱ��t�Ĺ�ϵͼ֪�����Ȼ�����Һ��2NaCl��2H2O Cl2����H2����2NaOH ����������������Һ��4AgNO3+2H2O
Cl2����H2����2NaOH ����������������Һ��4AgNO3+2H2O 4Ag+O2��+4HNO3����������������Һ��2H2O
4Ag+O2��+4HNO3����������������Һ��2H2O 2H2����O2�������ˮ����Ҫʹ���������Һ�ָ���ԭ����״̬��Ӧ����ˮ������Ag+ ~ Ag~ OH-֪n��Ag��=n��OH-��=27��108=0.25mol��c��OH-��=0.25mol ��25L=0.01mol/L��pH=12.
2H2����O2�������ˮ����Ҫʹ���������Һ�ָ���ԭ����״̬��Ӧ����ˮ������Ag+ ~ Ag~ OH-֪n��Ag��=n��OH-��=27��108=0.25mol��c��OH-��=0.25mol ��25L=0.01mol/L��pH=12.
��˼·�㲦���������ӹ����ж����ӵ���ϣ��ٽ�ϵ��ʱ��pH�仯�жϼס��ҡ�������ʲô��Һ��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
25 �桢101 kPa�£�̼������������������ǵ�ȼ����������393.5 kJ��mol-1��285.8 kJ��mol-1��890.3 kJ��mol-1��2 800 kJ��mol-1���������Ȼ�ѧ����ʽ��ȷ���� �� ��
A��C(s)+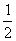 O2(g)====CO(g);��H=-393.5 kJ��mol-1
O2(g)====CO(g);��H=-393.5 kJ��mol-1
B��2H2(g)+O2(g)====2H2O(g);��H=+571.6 kJ��mol-1
C��CH4(g)+2O2(g)====CO2(g)+2H2O(g);��H=-890.3 kJ��mol-1
D��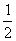 C6H12O6(s)+3O2(g)====3CO2(g)+3H2O(l);��H=-1 400 kJ��mol-1
C6H12O6(s)+3O2(g)====3CO2(g)+3H2O(l);��H=-1 400 kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����ͼ��ʾװ�ý�������ˮ������Ӧ��ʵ�顣
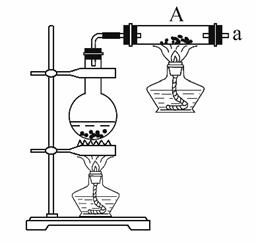
��1��������ˮ������Ӧ�Ļ�ѧ����ʽ�ǣ� ��
(2)Ϊ�������ɵ��������,�����ͼѡ���Ҫ��װ��,����ȷ������˳��Ϊ(�ýӿ���ĸ��ʾ)a�� ,������֤����������ʵ������_�� ��
��3��ֹͣ��Ӧ����װ����ȴ��ȡ����Ӧ�������ۻ������������ϡ�����ַ�Ӧ�����ˡ���������������Һ��Fe3���IJ��������� ��
��4��������������Һ�в���Fe3�����ⲻ��˵��������ˮ������Ӧ���ò����в�����3�۵�����ԭ���ǣ��û�ѧ����ʽ˵������ ��
��5��ijͬѧ����������Һ��ȡ��ɫ��Fe��OH��2����������Һ�м���NaOH��Һ�۲쵽���ɵİ�ɫ����Ѹ�ٱ�ɻ���ɫ������ɺ��ɫ��
�ٳ����ɰ�ɫ��Ϊ���ɫ�Ļ�ѧ����ʽ�ǣ� ��
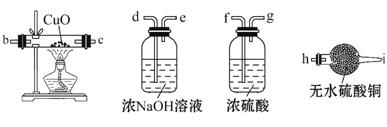
��Ϊ�˵õ���ɫ��Fe��OH��2��������������ʹ������ʱ�䱣�ְ�ɫ����ͬѧ�������ͼ��ʾ��װ�ã�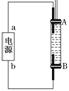 ͨ�����Һ�в��������İ�ɫ�������ҽϳ�ʱ�䲻��ɫ������˵������ȷ����________(�����)��
ͨ�����Һ�в��������İ�ɫ�������ҽϳ�ʱ�䲻��ɫ������˵������ȷ����________(�����)��
A����Դ�е�aΪ������bΪ���� B��������NaCl��Һ��Ϊ���Һ
C��A��B���˶������������缫 D�����������ķ�Ӧ��2H����2e��===H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������ڲ�ͬ�ܼ�����NaOH������ͬ���͵ķ�Ӧ�����ɲ�ͬ�ķ�Ӧ�����������������ʣ������������̽����
̽�������Թ��м���5 mL 1 mol/L NaOH��Һ��5 mL �����飬��
����ͼ������̨���ƾ����ԣ��̶�ʵ��װ�ú��Թ�ˮԡ���ȣ���֤ȡ����Ӧ�IJ���۲쵽__________________________����ʱ��������������NaOH��Һ����ȫ��Ӧ���䷢����Ӧ�ķ���ʽΪ�� ��
̽����Ϊ֤����������NaOH�Ҵ���Һ�з���������ȥ��Ӧ��
������Ƶ�ʵ�鷽���У���Ҫ���������______________________���ɡ�����������ֲ�ͬ�ķ����ֱ��������壬���ڱ���ָ��λ����дװ����ʢ�Լ�������(�Լ���ѡ)��ʵ������
| ͼ�� | װ��ͼ | ��ʢ�Լ� | ʵ������ |
| 1 |
| A��________B��________ | |
| 2 |
| C��________ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��4 mol����Alȫ��ת��ΪAl��OH��3������HCl a mol��NaOH b mol����a+b����СֵΪ�� ��
A��4 B��6 C��8 D��16
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�л���A��F������ת����ϵ��
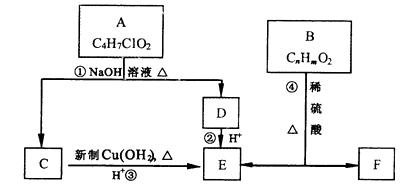
��֪һ��̼ԭ�������������ǻ�ʱ���ȶ���ת�����£�
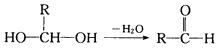
��ش�
��1��A�Ľṹ��ʽΪ�� ���ܵķ�Ӧ����
��2��C������Cu��OH��2�Ļ�ѧ����ʽΪ
��3����֪B��Ħ������Ϊ162g/mol����ȫȼ�յIJ�����n��CO2����n��H2O��=2��1��B�ķ���ʽΪ ��
��4��F�������߷��ӹ��������Ҫԭ�ϣ��ص����£�
���ܷ����Ӿ۷�Ӧ �ں��б����ұ�����һ��ȡ����ֻ������ ����FeCl3����ɫ
F��Ũ��ˮ��Ӧ�Ļ�ѧ����ʽ
B��NaOH��Ӧ�Ļ�ѧ����ʽ
��5��F��һ��ͬ���칹��G���������ܷ���������Ӧ��д��һ������������G�Ľṹ��ʽ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
һ�������£����淴ӦN2 +3H2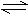 2NH3������ӦΪ���ȷ�Ӧ���ﵽƽ�⣬�������ı������������й�����������ǣ� ��
2NH3������ӦΪ���ȷ�Ӧ���ﵽƽ�⣬�������ı������������й�����������ǣ� ��
A���Ӵ�����V����V�� �������仯���ұ仯�ı������
B����ѹ��V����V�� ��������V�� ����ı�������V�� ����ı���
C�����£�V����V�� ����С����V�� ��С�ı�������V�� ��С�ı���
D����������Ũ�ȣ�V����V�� ��������V�� ����������V�� ��������N2 ת���ʼ�С��H2ת��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���и������ʣ����ջ�������ʣ������˳�����е���(����)
A���ռҺ̬�������
B����ʯ�ҡ����ס���ʯ��
C���ɱ��������Ȼ���
D������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��5.4g AlͶ��200.0mL 2.0mol•L��1��ij��Һ����������������ַ�Ӧ���н���ʣ�࣮����Һ����Ϊ��������
| �� | A�� | HNO3��Һ | B�� | Ba��OH��2��Һ | C�� | H2SO4��Һ | D�� | HCl��Һ |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com