
【题目】将等物质的量的A、B、C、D四种物质混合放入VL密闭容器中,发生如下反应:aA+bB![]() cC(s)+dD,当反应进行到第t min时,测得A减少了n mol,B减少了0.5nmol,C增加了1.5n mol,D增加了n mol。此时反应达到平衡。
cC(s)+dD,当反应进行到第t min时,测得A减少了n mol,B减少了0.5nmol,C增加了1.5n mol,D增加了n mol。此时反应达到平衡。
(1)以B的浓度变化表示的该反应的速率为v (B)= 。
(2)该化学方程式中,各物质的化学计量数分别为:a b c d
(3)若只改变压强,反应速率变化但平衡状态不移动,则各物质的聚集状态分别是:A B D 。若在上述平衡混合物中再加入B物质,上述平衡
A.向正反应方向移动 B.向逆反应方向移动
C.不移动 D.条件不够,无法判断
(4)若只升高温度,反应一段时间后,测知四种物质的物质的量又达到相等,则该反应为 反应。(填“放热”或“吸热”)
【答案】(1)![]() mol·/(L·min)
mol·/(L·min)
(2)2 1 3 2
(3)气体 固体或液体(非气体) 气体 C (4) 放热
【解析】
试题分析:(1)v(B)=![]() /tmin=
/tmin=![]() mol/(L·min)。
mol/(L·min)。
(2)反应转化的各物质的物质的量之比为
n(A)∶n(B)∶n(C)∶n(D) =nmol∶![]() mol∶
mol∶![]() mol∶nmol=2∶1∶3∶2,因此a、b、c、d分别是2、1、3、2;
mol∶nmol=2∶1∶3∶2,因此a、b、c、d分别是2、1、3、2;
(3)改变压强,反应速率改变,表明A、B、D中至少有一种是气体,而平衡并不发生移动,说明左、右两边气体物质的化学计量数之和相等,因而只可能A、D是气体而B不是气体。若在上述平衡混合物中再加入B物质,B不是气态,因此上述平衡不移动,答案选C;
(4)升高温度,平衡向逆反应方向移动,则正反应为放热反应。


科目:高中化学 来源: 题型:
【题目】下列各组物质中,不能按图示(“→”表示一步完成)关系相互转化的是
选项 | a | b | c |
A | Fe | FeCl3 | FeCl2 |
B | H2SO4 | SO2 | SO3 |
C | Si | SiO2 | H2SiO3 |
D | HNO3 | NO | NO2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积可变的密闭容器中,加入一定量的X、Y、Z,发生反 应mX(g) ![]() nY(g)+pZ(s) △H = Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如表所示:
nY(g)+pZ(s) △H = Q kJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如表所示:
下列说法正确的是( )
气体体积/L c(Y)/molL-1 温度/℃ | 1 | 2 | 3 |
100 | 1.00 | 0.75 | 0.53 |
200 | 1.20 | 0.90 | 0.63 |
300 | 1.30 | 1.00 | 0.70 |
A.m>n+p
B.Q<0
C.温度不变,压强增大,Y的体积分数减少
D.体积不变,温度升高,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验或操作不能达到目的的是( )
A. 制取溴苯:将铁屑、溴水、苯混合加热
B. 用 NaOH 溶液除去溴苯中的溴
C. 鉴别己烯和苯:向己烯和苯中分别滴入酸性 KMnO4 溶液,振荡,观察是否褪色
D. 除去甲烷中含有的乙烯:将混合气体通入溴水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关过滤和蒸发的操作中,正确的是( )
A. 过滤时,漏斗的下端管口紧靠烧杯内壁
B. 为了加快过滤速度,可用玻璃棒搅动过滤器中的液体
C. 实验完毕后,用手直接取走蒸发皿
D. 当蒸发皿中的固体完全蒸干后,再停止加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定体积的密闭容器中,进行化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g)达到平衡状态,其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g)达到平衡状态,其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K[来 | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K= ;再充入CO2气体,则平衡 移动(选“正向移动”、“逆向移动”或“不移动”),平衡常数K (选“增大”、“减小”或“不变”)。
(2)该反应的逆反应方向为 反应方向(选填吸热、放热)。
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分)。
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下的各物质平衡浓度符合:c(CO2)=c(CO),c(H2)=c(H2O),试判断此时的温度为 ℃。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)对于下列反应:2SO2+O2![]() 2SO3, 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么用SO2浓度变化来表示的化学反应速率为 ,用O2浓度变化来表示的反应速率为 。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)=0.5mol/(L·min),那么2min末SO2的浓度为 。
2SO3, 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么用SO2浓度变化来表示的化学反应速率为 ,用O2浓度变化来表示的反应速率为 。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)=0.5mol/(L·min),那么2min末SO2的浓度为 。
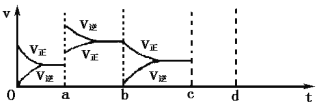
(2)下图左表示在密闭容器中反应:2SO2+O2![]() 2SO3 H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,ab过程中改变的条件可能是 ;bc过程中改变的条件可能是 ;将增大压强时反应速率变化情况画在c—d处。
2SO3 H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,ab过程中改变的条件可能是 ;bc过程中改变的条件可能是 ;将增大压强时反应速率变化情况画在c—d处。
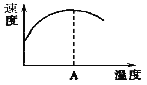
(3)酶是蛋白质,具有蛋白质的特性,酶能催化很多化学反应,上图右表示酶参加的反应中温度与反应速率的关系,解释曲线变化原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容密闭容器中,下列说法不能表明反应A(s)+2B(g)![]() C(g)+D(g)已达平衡的是( )
C(g)+D(g)已达平衡的是( )
A.B的物质的量浓度 B.混合气体的压强不变
C.混合气体的密度 D.混合气体的相对分子质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列物质:CO2、N2、CaCl2、NH4Cl、NaOH、H2O2、Na2O2。
(1)属于共价化合物的有_______________,含有非极性键的离子化合物的是__________。
(2)N2、CO2的结构式分别为________________、_________________。
(3)分别写出NaOH、H2O2、Na2O2的电子式:_______________、_____________、______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com